Niet-innocente ligand
Een niet-innocente ligand[Opm. 1] in een metaal-complex is een ligand waarvan de oxidatietoestand niet op voorhand vastligt. In redoxreacties van complexen met metalen die meerdere valenties kunnen aannemen zal tijdens deze reactie meestal het metaal-ion van oxidatietoestand wisselen. In het geval van een niet-innocent ligand is het juist de ligand die elektronen opneemt of afstaat.
Het begrip niet-innocente ligand gaat ervan uit dat bij de redox-reactie van een metaal-complex ofwel de oxidatietoestand van het metaal, ofwel die van de ligand verandert. Hoewel het een versimpeling is van de werkelijke situatie, levert het wel een werkbaar concept op.[1]
C.K. Jørgensen is de eerste geweest die liganden verdeelde in innocent en suspect. Het laatste begrip wordt hier als niet-innocent aangeduid. Liganden worden als innocent beschouwd als ze het mogelijk maken de oxidatietoestand van het metaal-ion eenduidig te bepalen. Het eenvoudigste geval van een suspect of niet-innocent ligand is nitrosyl .[2]
In het algemeen geldt dat complexen met niet-innocente liganden absoluut gezien relatief lage redox-potentialen vertonen.
Redoxreacties van complexen met innocente en niet-innocente liganden
Innocent
De klassieke benadering van redoxreacties van coördinatie-verbindingen ging uit van het oxideren of reduceren van het metallische centrum ervan. Zo wordt de reductie van permanganaat naar manganaat beschreven als het reduceren van mangaan(VII) naar mangaan(VI):
Voor de oxide-liganden verandert de oxidatie-toestand niet, deze blijft (-2). Zuurstof is hier een innocente ligand.[Opm. 2] Een ander voorbeeld wordt gevormd door het Hexamminekobalt(III)-complex als dat gereduceerd wordt tot het kobalt(II)-complex:
In deze omzetting is ammonia een innocente ligand.
Een ander voorbeeld van een innocente ligand is cyanide in het redoxkoppel geel en rood bloedloogzout. In Elektrochemie voor MBO[3] wordt aangetoond dat de complexvorming wel effect heeft op de onderlinge verhouding van de concentraties, maar niet op de redoxpotentiaal van het onderliggende ijzer(II)/ijzer(III)-koppel.
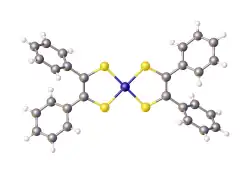 nikkelbis(stilbeendithiolaat)
nikkelbis(stilbeendithiolaat)Niet-innocent
Een voorbeeld van niet-innocent ligand-gedrag treedt op in nikkelbis(stilbeendithiolaat) (zie hieronder, figuur 1). In zijn neutrale vorm heeft de ligand, zonder gebonden te zijn aan nikkel, op elk zwavel-atoom nog een waterstof-atoom. Deze ontbreken in het complex, dus de lading van de ligand in het complex is 2 min (2 liganden elk -2, nikkel is +2). Net als de andere nd8-complexen (complexen waarbij het metaal-ion 8 elektronen in de 3d-schil heeft) kunnen er drie oxidatie-niveau's voor het complex onderscheiden worden: z = -2, -1 en 0. Als de ligand steeds, zoals bij de klassieke benadering van complexen gebruikelijk is, zijn lading behoudt, moet het centrale nikkel-ion hiervoor de formele oxidatietoestanden van +2 tot +4 doorlopen.
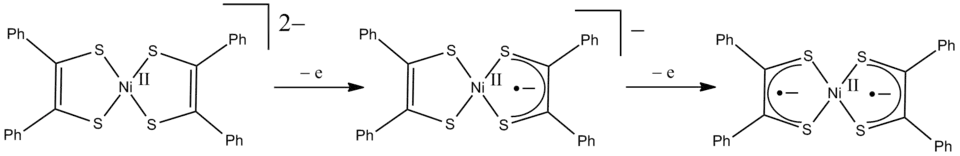
De (spectroscopisch) experimentele gegevens wijzen echter uit dat de elektronensituatie rond nikkel niet echt wijzigt. Het stilbeendithiolaat gedraagt zich als een redox niet-innocente ligand. De oxidatie vindt vooral plaats in de ligand, en niet op het metaal. Hierbij ontstaan ligand-radicaalcomplexen. Het neutrale complex, in figuur 1 de meest rechtse structuur, vertoont eigenschappen van een singlet diradicaal,[4] waardoor dit beter beschreven wordt als een complex van met het radicaal anion . Het diamagnetisme van het complex wordt toegeschreven aan de interactie tussen de twee ongepaarde elektronen in de liganden.
Een ander voorbeeld van niet-innocente liganden treedt op in de diamidofenylcomplexen van koper.[5]
Typische niet-innocente liganden
- Eenvoudige liganden:
- Nitrosyl kan op twee totaal verschillende manieren aan metalen binden:
- op een gehoekte manier waarbij stikstofoxide als pseudohalogeen aan het metaal gekoppeld is en
- op een lineaire manier, waarbij het zich als gedraagt.
- Dizuurstof[6]
- als het superoxide-ion
- als het peroxide-ion of
- Nitrosyl kan op twee totaal verschillende manieren aan metalen binden:
- Liganden met een uitgebreid, gedelokaliseerd π-systeem zoals porfyrines, ftalocyanines, corrolen[7] en liganden met de algemene formule (met D = O, S, NR' en R, R' = alkyl of aryl, de groepen R kunnen ook met de dubbele band tussen de koolstofatomen een aromatische ring vormen) zijn vaak niet-innocent, terwijl de algemene structuur meestal aanleiding geeft tot innocente liganden. Voorbeelden in deze laatste groep zijn: acetylaceton, salen-liganden en de van die stamverbindingen afgeleide stoffen.
- Catecholaten en verwante vicinale dioxo-verbindingen.[8]
- Dithiolenen, zoals maleonitrildithiolaat of het in figuur 1 weergegeven stilbeendithiolaat.
- 1,2-di-imines zoals derivaten van o-fenyleendiamine (salen), 2,2'-bipyridine (PyPy) en dimethylglyoxime. Het complex is een -complex met 3 bipyridine-liganden. Bipyridine gedraagt zich niet altijd als een niet-innocente ligand: de één-elektron-oxidatie van betreft een oxidatie van ruthenium en de bipyridine-liganden gedragen zich in dat geval innocent.
- In liganden met ferroceen-derivaten, gebruikt in katalysatoren, kunnen redox-reacties optreden in het ferroceen-deel van de katalysator in plaats van in het katalytische actieve centrum.[9]
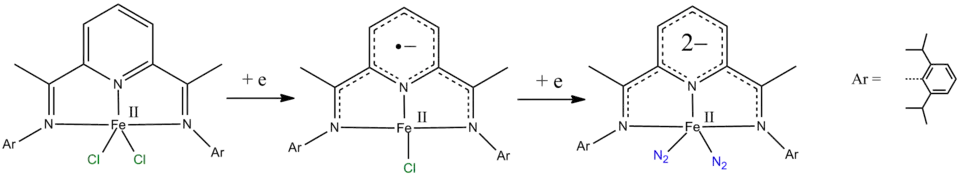
- pyridine-2,6-diimine liganden ( Zie figuur 2) kunnen zowel één- als twee-elektron-reducties ondergaan.[10][11][12]
Redox niet-innocente liganden in biologie en homogene katalyse
In een aantal enzymatische redoxreacties zijn niet-innocente cofactoren betrokken bij de redox-eiegenschappen van metallo-enzymen. De meeste in de natuur voorkomende redox-reacties hebben betrekking op innocente liganden, zoals bijvoorbeeld ferredoxine, waarbij de redox in een -cluster plaatsvindt. De extra reductie-mogelijkheden die niet-innocente liganden bieden worden toegepast in het sturen van homogene katalytische processen.[13][14][15]
Heem
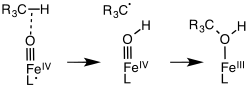
Heemverbindingen met op porfyrine gebaseerde liganden kunnen zowel niet-innocent (wisseling tussen -1 en -2) als innocent (-2) zijn. In de enzymen cytochroom P450 en chloroperoxidase ondersteund de oxidatie, met name in de vorming van "compound I", een -verbinding met een éénwaardig radicaal-aninion als ligand. In de figuur hiernaast is een en ander weergegeven voor de omzetting van koolwaterstoffen in alkanolen. In andere heem-achtige liganden, bijvoorbeeld myoglobine gedraagt de ligand zich innocent.
Galactose-oxidase
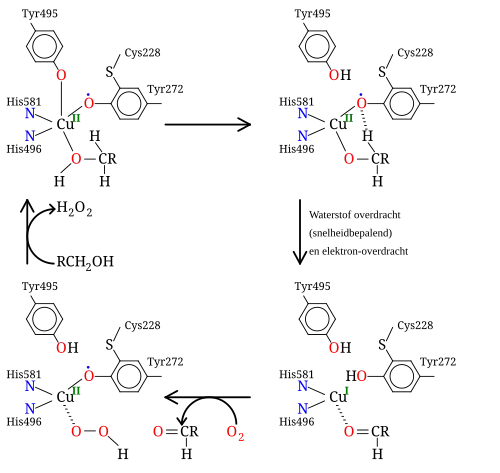
Galactose-oxidase (GOase) een enzym dat voorkomt in bepaalde soorten schimmels, zet de eindstandige -groep van galactose (en andere primaire alkanolen) om in de overeenkomstige aldehyde-functie. Als katalysator komt GOase netto onveranderd door de cyclus. Het enzym is een voorbeeld van een niet-innocente ligand.[16][17]
GOase oxideert met behulp van O2 primaire alkanolen naar aldehydes. In het actieve centrum van GOase is een tyrosyl-residu coördinatief gekoppeld aan een -ion. In de snelheidsbepalende stap van de cyclus wordt de alkanol gedeprotoneerd door een in het enzym aanwezige Brønsted-base, waarna het zuurstofatoom van het tyrosinyl-radicaal een waterstof-atoom ontrekt aan het via coörfdinatie gekoppelde alkoxide-substraat. De oxidatie betreft 2 elektronen, maar deze worden verdeeld over:
- het koper-ion:
- in de overdracht van het waterstof-atoom naar het tyrosinyl-radicaal wordt een netto neutraal waterstof-radicaal overgedragen.
De radicaal-overdracht is een snelle reactie. Anti-ferromagnetische koppeling tussen de ongepaarde spins op het tyrosinyl-radicaal en die op d9 CuII geeft aanleiding tot een diamagnetische grondtoestand, wat in overeenstemming is met modellen.[18]
Zie ook
- Electromerie
- Isomerie
- Redoxreactie
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Non-innocent ligand op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Opmerkingen in de tekst
- ↑ Bij het vertalen van het Engelse artikel is de daar gebruikte aanduiding "overgezet". Vertalen van de term zou niet-onschuldige ligand opleveren, wat de lading niet dekt. Begrippen als vrijblijvend of neutraal doen dat ook niet. Deze keuze betekent wel dat er soms een wat juridisch klinkende terminologie gebruikt wordt bij de beschrijving van dit soort liganden.
- ↑ Hoewel een nauwkeurig onderzoek van de elektronenstructuur van de twee redox-partners aangeeft dat ook de zuurstof-liganden beïnvloed worden door de wijziging op mangaan, is dit effect minimaal, en de formele oxidatie-toestand blijft gelijk.
Verwijzingen in de tekst
- ↑ (en) Ganguly, Sumit; Ghosh, Abhik (16 juli 2019). Seven Clues to Ligand Noninnocence: The Metallocorrole Paradigm. Accounts of Chemical Research 52 (7), pag.: 2003–2014. ISSN: 0001-4842. PMID: 31243969. DOI: 10.1021/acs.accounts.9b00115.
- ↑ Jørgensen CK (1966). Differences between the four halide ligands, and discussion remarks on trigonal-bipyramidal complexes, on oxidation states, and on diagonal elements of one-electron energy. Coordination Chemistry Reviews 1 (1–2), pag.: 164–178. DOI: 10.1016/S0010-8545(00)80170-8.
- ↑ Elektrochemie voor MBO/Andere evenwichten, complexvorming op wikibooks
- ↑ Aragoni, M. Carla; Caltagirone, Claudia; Lippolis, Vito; Podda, Enrico; Slawin, Alexandra M. Z.; Woollins, J. Derek; Pintus, Anna; Arca, Massimiliano (7 december 2020). Diradical Character of Neutral Heteroleptic Bis(1,2-dithiolene) Metal Complexes: Case Study of [Pd(Me2timdt)(mnt)] (Me2timdt = 1,3-Dimethyl-2,4,5-trithioxoimidazolidine; mnt2– = 1,2-Dicyano-1,2-ethylenedithiolate). Inorganic Chemistry 59 (23), pag.: 17385–17401. ISSN: 0020-1669. PMID: 33185438. PMC: 7735710. DOI: 10.1021/acs.inorgchem.0c02696.
- ↑ Rajabimoghadam, Khashayar; Darwish, Yousef; Bashir, Umyeena; Pitman, Dylan; Eichelberger, Sidney; Siegler, Maxime A.; Swart, Marcel; Garcia-Bosch, Isaac (2018). Catalytic Aerobic Oxidation of Alcohols by Copper Complexes Bearing Redox-Active Ligands with Tunable H-Bonding Groups. Journal of the American Chemical Society 140 (48), pag.: 16625–16634. PMID: 30400740. PMC: 6645702. DOI: 10.1021/jacs.8b08748.
- ↑ Kaim W, Schwederski B (2010). Non-innocent ligands in bioinorganic chemistry—An overview. Coordination Chemistry Reviews 254 (13-14) (13–14), pag.: 1580–1588. DOI: 10.1016/j.ccr.2010.01.009.
- ↑ (en) Ghosh, Abhik (22 februari 2017). Electronic Structure of Corrole Derivatives: Insights from Molecular Structures, Spectroscopy, Electrochemistry, and Quantum Chemical Calculations. Chemical Reviews 117 (4), pag.: 3798–3881. ISSN: 0009-2665. PMID: 28191934. DOI: 10.1021/acs.chemrev.6b00590.
- ↑ Zanello P, Corsini M (2006). Homoleptic, mononuclear transition metal complexes of 1,2-dioxolenes: Updating their electrochemical-to-structural (X-ray) properties. Coordination Chemistry Reviews 250 (15–16), pag.: 2000–2022. DOI: 10.1016/j.ccr.2005.12.017.
- ↑ Wang X, Thevenon A, Brosmer JL, Yu I, Khan SI, Mehrkhodavandi P, Diaconescu PL (August 2014). Redox control of group 4 metal ring-opening polymerization activity toward L-lactide and ε-caprolactone. J. Am. Chem. Soc. 136 (32), pag.: 11264–7. PMID: 25062499. DOI: 10.1021/ja505883u.
- ↑ de Bruin B, Bill E, Bothe E, Weyhermüller T, Wieghardt K (June 2000). Molecular and electronic structures of bis(pyridine-2,6-diimine)metal complexes [ML2](PF6)n (n = 0, 1, 2, 3; M = Mn, Fe, Co, Ni, Cu, Zn). Inorg Chem 39 (13), pag.: 2936–47. PMID: 11232835. DOI: 10.1021/ic000113j.
- ↑ Chirik PJ, Wieghardt K (February 2010). Chemistry. Radical ligands confer nobility on base-metal catalysts. Science 327 (5967), pag.: 794–5. PMID: 20150476. DOI: 10.1126/science.1183281.
- ↑ Chirik, P. J. (2010). Catalysis without Precious Metals, Chapter 4. Modern Alchemy: Replacing Precious Metals with Iron in Catalytic Alkene and Carbonyl Hydrogenation Reactions, in Catalysis without Precious Metals, pag.: 83. DOI: 10.1002/9783527631582.ch4.. ISBN 978-3-527-63158-2.
- ↑ Lyaskovskyy V, de Bruin B (2012). Redox Non-Innocent Ligands: Versatile New Tools to Control Catalytic Reactions. ACS Catalysis 2 (2), pag.: 270–279. DOI: 10.1021/cs200660v.
- ↑ (February 2013). Redox-active ligands in catalysis. Chem Soc Rev 42 (4): 1440–59. PMID 22975722. DOI: 10.1039/c2cs35228a.
- ↑ (en) Chirila, Andrei; Das, Braja Gopal; Kuijpers, Petrus F.; Sinha, Vivek; Bruin, Bas de (2018). Application of Stimuli-Responsive and "Non-innocent" Ligands in Base Metal Catalysis, pag.: 1–31 (John Wiley & Sons, Ltd). DOI: 10.1002/9783527699087.ch1.. ISBN 9783527699087.
- ↑ Whittaker MM, Whittaker JW (March 1993). Ligand interactions with galactose oxidase: mechanistic insights. Biophys. J. 64 (3), pag.: 762–72. PMID: 8386015. PMC: 1262390. DOI: 10.1016/S0006-3495(93)81437-1.
- ↑ Wang Y, DuBois JL, Hedman B, Hodgson KO, Stack TD (January 1998). Catalytic galactose oxidase models: biomimetic Cu(II)-phenoxyl-radical reactivity. Science 279 (5350), pag.: 537–40. PMID: 9438841. DOI: 10.1126/science.279.5350.537.
- ↑ Müller J, Weyhermüller T, Bill E, Hildebrandt P, Ould-Moussa L, Glaser T, Wieghardt K (March 1998). Why Does the Active Form of Galactose Oxidase Possess a Diamagnetic Ground State?. Angew. Chem. Int. Ed. Engl. 37 (5), pag.: 616–619. PMID: 29711069. DOI: <616::AID-ANIE616>3.0.CO;2-4 10.1002/(SICI)1521-3773(19980316)37:5<616::AID-ANIE616>3.0.CO;2-4.
Algemene referenties
- Dzik, W. I.., Zhang, X. P., de Bruin, B. (2011). Redox Noninnocence of Carbene Ligands: Carbene Radicals in (Catalytic) C-C Bond Formation. Inorganic Chemistry 50 (20), pag.: 9896–9903. PMID: 21520926. DOI: 10.1021/ic200043a.
- Büttner, T., Geier, J., Frison, G., Harmer, J., Calle, C., Schweiger, A., Schönberg, H., Grützmacher, H. (2005). A Stable Aminyl Radical Metal Complex. Science 307 307 (5707), pag.: 235–238. PMID: 15653498. DOI: 10.1126/science.1106070.
- Hetterscheid, D.G.H., Kaiser, J., Reijerse, E., Peters, T.P.J., Thewissen, S., Blok, A.N.J., Smits, J.M.M., de Gelder, R., de Bruin, B. (2005). IrII(ethene): Metal or Carbon Radical?. Journal of the American Chemical Society 127 (6), pag.: 1895–1905. PMID: 15701024. DOI: 10.1021/ja0439470.
- Blanchard, S., Derat, E., Desage-El Murr, M., Fensterbank, L., Malacria, M, Mouriès-Mansuy, V. (2012). Non-Innocent Ligands: New Opportunities in Iron Catalysis. European Journal of Inorganic Chemistry 2012 (3), pag.: 376–389. DOI: 10.1002/ejic.201100985.
- Kaim, W. (2012). The Shrinking World of Innocent Ligands: Conventional and Non-Conventional Redox-Active Ligands. European Journal of Inorganic Chemistry 2012 (3), pag.: 343–348. DOI: 10.1002/ejic.201101359.