o-Fenyleendiamine
| o-Fenyleendiamine[1] | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||
| ||||||
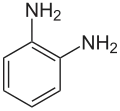
Structuurformule van o-Fenyleendiamine
| ||||||
| ||||||
| ||||||
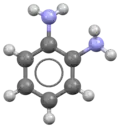
Ruimtelijk model van o-Fenyleendiamine
| ||||||
| Algemeen | ||||||
| Molecuulformule | ||||||
| IUPAC-naam | Benzeen-1,2-diamine | |||||
| Andere namen | 1,2-Diaminobenzeen, 1,2-Fenyleendiamine, o-diaminobenzeen | |||||
| Molmassa | 108,144 g/mol | |||||
| SMILES | Nc1ccccc1N
| |||||
| InChI | 1/C6H8N2/c7-5-3-1-2-4-6(5)8/h1-4H,7-8H2
| |||||
| CAS-nummer | 95-54-5 | |||||
| EG-nummer | 202-430-6 | |||||
| PubChem | 7243 | |||||
| Wikidata | Q3596763 | |||||
| Beschrijving | Witte, vaste stof | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H301 - H312 - H317 - H319 - H332 - H341 - H351 - H410 | |||||
| P-zinnen | P201 - P202 - P261 - P264 - P270 - P271 - P272 - P273 - P280 - P281 - P301+P310 - P302+P352 - P304+P312 - P304+P340 - P305+P351+P338 - P308+P313 - P312 - P321 - P322 - P330 - P333+P313 - P337+P313 - P363 - (P) - P391 - P405 - P501 | |||||
| VN-nummer | 1673 | |||||
| Fysische eigenschappen | ||||||
| Dichtheid | 1.031 g/cm³ | |||||
| Smeltpunt | 102-4 °C | |||||
| Kookpunt | 252 °C | |||||
| Vlampunt | 156 °C | |||||
| Oplosbaarheid in water | Oplosbaar in heet water | |||||
| Evenwichtsconstante(n) | pKz2 = 0,8[3] pKz1 = 4,57[4] | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
o-Fenyleendiamine (OFD) is een organische verbinding met de brutoformule , of met meer nadruk op de structuur ervan: . Deze aromatische verbinding is een belangrijke uitgangsstof voor veel heterocyclische verbindingen. OFD zelf is een witte, vaste stof, maar monsters worden in de loop van de tijd donkerder ten gevolge van lucht-oxidatie. De stoffen m-fenyleendiamine en p-fenyleendiamnine zijn isomeren van OFD.
Synthese
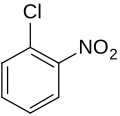
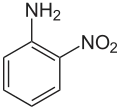
Gewoonlijk wordt OFD in een tweestaps-synthese uit 1-chloor-2-nitrobenzeen bereid, door dit eerst te laten reageren met een tweevoudige overmaat ammoniak. Hierbij ontstaat 2-nitroaniline. De nitrogroep wordt vervolgens gereduceerd:[5]
Stap 1:
Stap 2:

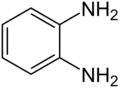
Technisch wordt de tweede stap uitgevoerd met waterstof in tolueen als oplosmiddel. Het diamine wordt vervolgens via destillatie gezuiverd.[6] Op laboratoriumschaal wordt de laatste stap meestal gerealiseerd met behulp van zinkpoeder in ethanol. De zuivering van het diamine vindt dan plaats via het hydrochloride. Een donker verkleurde hoeveelheid OFD kan gezuiverd worden door behandeling van de waterige oplossing ervan met natriumdithioniet en actieve kool.[7]
Reacties en toepassingen
o-Fenyleendiamine condenseert met aldehydes en ketonen tot een grote verscheidenheid aan waardevolle producten. Met mierenzuur wordt benzimidazool gevormd.[8] Met andere carbonzuren ontstaan 2-gesubstitueerde benzimidazolen.

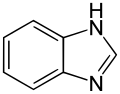
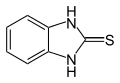
De herbicides benomyl, fuberidazool en thiofanaat-methyl[5] worden op deze manier gemaakt. De condensatie-reactie met kaliumethylxanthaat levert 2-mercaptobenzimidazool.[9]

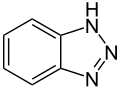
Met salpeterigzuur ontstaat benzotriazool, een corrosieremmer.[10]

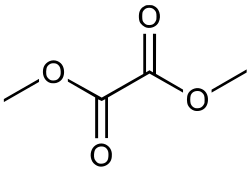
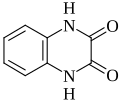
Quinoxaline-2,3-dion kan gesynthetiseerd worden door OFD met dimethyloxalaat te laten reageren.

De reactie van OFD met diketonen is een belangrijke stap in de bereidig van een aantal geneesmiddelen.[11]
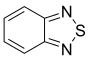
Met salicylaldehyde wordt een salen-ligand gevormd,met thionylchloride ontstaat 2,1,3-benzothiadiazool.

OFD kan als ligand optreden in compexen met metalen. Oxidatie van OFD-metaalcomplexen geeft een di-imine-complex.[12]
Veiligheid
Met een LD50 van 44 mg/L (in water) is OFD ongeveer 1000 keer minder toxisch dan het p-isomeer, maar heel erg hoog is deze waarde ook weer niet. Als aromatisch amine is de stof bovendien waarschijnlijk carcinogeen, en dient dus met de daarbij horende zorg behandeld te worden. In veel oude toepassingen van OFD is de stof vervangen door veiliger alternatieven, zoals 3,3',5,5'-tetramethylbenzidine.[13]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel o-Phenylenediamine op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Externe link:
Verwijzingen in de tekst
- ↑ DuPont Specialty Intermediates: o-Phenylenediamine (OPD). Gearchiveerd op 22 juni 2008. Geraadpleegd op 25 april 2006.
- ↑ Hazardous Substances Data Bank (HSDB) : 2893 - PubChem. PubChem.
- ↑
- ↑
- ↑ a b Sjabloon:Ullmann
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 536, 542.
- ↑ E. L. Martin (1939). o-Phenylenediamine. Organic Syntheses 19. DOI: 10.15227/orgsyn.019.0070.
- ↑ Wagner, E. C.; Millett, W. H. (1939). Benzimidazole. Organic Syntheses 19, pag.: 12. DOI: 10.15227/orgsyn.019.0012.
- ↑ VanAllan, J. A.; Deacon, B. D. (1950). 2-Mercaptobenzimidazole. Organic Syntheses 30, pag.: 56. DOI: 10.15227/orgsyn.030.0056.
- ↑ Damschroder, R. E.; Peterson, W. D. (1940). 1,2,3-Benzotriazole. Organic Syntheses 20, pag.: 16. DOI: 10.15227/orgsyn.020.0016.
- ↑ Bijvoorbeeld: Renault, J. (1981). Heterocyclic quinones. Quinoxaline-5,6 and 5,8 diones, potential antitumoral agents. Eur. J. Med. Chem. 16, pag.: 545–550.
- ↑ Broere, Daniël L. J.; Plessius, Raoul; Van Der Vlugt, Jarl Ivar (2015). New Avenues for Ligand-Mediated Processes – Expanding Metal Reactivity by the Use of Redox-Active Catechol, o-Aminophenol and o-Phenylenediamine Ligands. Chemical Society Reviews 44 (19), pag.: 6886–6915. PMID: 26148803. DOI: 10.1039/C5CS00161G.
- ↑ Deshpande SS (1996). Enzyme Immunoassays: From Concept to Product Development. Chapman & Hall, New York, 169. ISBN 978-0-412-05601-7.



