Salen (chemie)
| Salen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
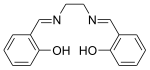
Structuurformule van
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Andere namen | 2,2′-Ethyleenbis(nitrilomethylidene)difenol, N,N′-Ethylenebis(salicylimine) | |||
| Molmassa | 268,32 g/mol | |||
| SMILES | C1=CC=C(C(=C1)/C=N/CC/N=C/C2=CC=CC=C2O)O
| |||
| InChI | 1S/C16H16N2O2/c19-15-7-3-1-5-13(15)11-17-9-10-18-12-14-6-2-4-8-16(14)20/h1-8,11-12,19-20H,9-10H2/b17-11+,18-12+
| |||
| CAS-nummer | 129409-01-4 | |||
| PubChem | 26518 | |||
| Wikidata | Q3042079 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| P-zinnen | P261 - P264 - P271 - P280 - P302+P352 - P304+P340 - P305+P351+P338 - P312 - P321 - P332+P313 - P337+P313 - P362 - P403+P233 - P405 - P501 | |||
| EG-Index-nummer | 202-376-3 | |||
| ||||
Salen kan in de chemie verwijzen naar:
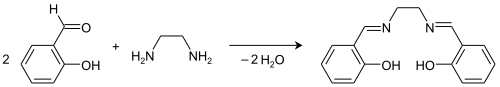
- het eerste tetradentaat ligand in deze klasse, verkregen uit de reactie van salicylaldehyde (sal) en ethyleendiamine (en). De structuurformule in de infobox is van deze verbinding.
- andere tetradentaat liganden gebaseerd op de condensatiereactie van andere 1,2-diamines met vergelijkbare β-hydroxyaldehyden of β-hydroxyketonen.
Het oorspronkelijke salen heeft C2-symmetrie. Salen kan ook beschouwd worden als een dubbele Schiff-base. Salen-liganden zijn in staat een groot aantal metaal-ionen te complexeren. Verschillende oxidatie-toestanden zijn daarbij geen bezwaar.[1] Deze eigenschap wordt toegepast als het wordt toegevoegd aan motorbrandstoffen om allerlei metalen (slijtage van motoronderdelen)te deactiveren of als katalysator.[2] Omdat salen makkelijk complexen vormt, waarbij de fenolische waterstof-atomen afgestaan worden, wordt de neutrale verbinding, zonder gecomplexeerd metaal, meestal als genoteerd.
Synthese en complexvorming
H2salen kan makkelijk bereid worden in de condensatiereactie van ethyleendiamine en salicylaldehyde.[3]
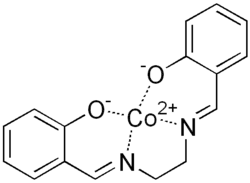
Complexen van metalen met salen kunnen vaak in situ gemaakt worden: na de condensatiereactie wordt H2Salen niet geïsoleerd, maar laat men het direct met een bron van het gewenste metaal-ion reageren.[4][5]
|
.png)
| |
| Salcomine, een complex van salen met kobalt | Jacobsen's salen-Mn katalysator |
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Salen ligand op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Zie ook: Bisthiosemicarbazones, een structureel verwante klasse van liganden.
- ↑ (en) Cozzi, Pier Giorgio (2004). Metal–Salen Schiff base complexes in catalysis: practical aspects. Chem. Soc. Rev. 33 (7), pag.: 410–421. PMID: 15354222. DOI: 10.1039/B307853C.
- ↑ (en) Shaw, Subrata; White, James D. (11 June 2019). Asymmetric Catalysis Using Chiral Salen–Metal Complexes: Recent Advances. Chemical Reviews 119 (16), pag.: 9381–9426. PMID: 31184109. DOI: 10.1021/acs.chemrev.9b00074.
- ↑ (de) Tsumaki, T. (1938). Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan 13 (2), pag.: 252–260. DOI: 10.1246/bcsj.13.252.
- ↑ (en) Diehl, Harvey, Hach, Clifford C. (1950). Inorganic Syntheses. DOI:10.1002/9780470132340.ch53, "Bis( N,N '-Disalicylalethylenediamine)-μ - Aquodicobalt(II)", 196–201. ISBN 978-0-470-13234-0.
- ↑ (en) Pier Giorgio Cozzi (2004). Metal-Salen Schiff base complexes in catalysis: Practical aspects. Chem. Soc. Rev. 33 (7): 410–421. PMID 15354222. DOI: 10.1039/B307853C.