Corrool
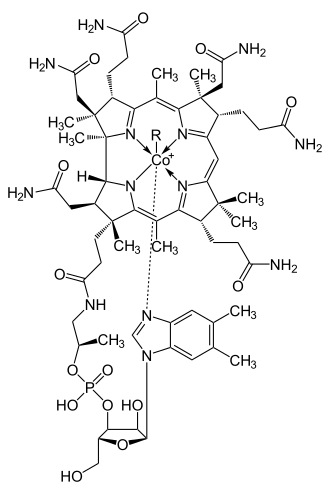
Een corrool is een aromatisch tetrapyrrool. De corrine-ring komt ook voor in cobalamine. Het centrale deel van het molecuul bestaat uit een ring van 19 koolstof- en 4 stikstof-atomen. Hiermee komen corrines structureel erg overeen met porfyrines.
Synthese
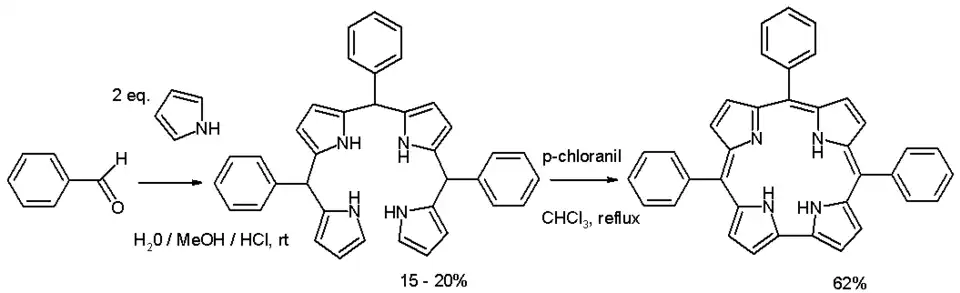
Corrolen worden in een tweestaps proces gesynthetiseerd, beginnend met de condensatiereactie van benzaldehyde met pyrrool. Dit resulteert in een product dat wel al alle koolstof- en stikstof-atomen bevat, maar de macrocyclische ring is nog niet gesloten. Deze verbinding wordt een bilaan of tetrapyrraan genoemd. De ringsluiting is een oxidatie-reactie, waarvoor vaak chloranil gebruikt wordt:[1]
Vergelijking met porfyrines
Hoewel corrolen en porfyrines veel op elkaar lijken zijn er ook een aantal duidelijke verschillen:
- Vanuit zuur-base oogpunt bekeken zijn corrolen driewaardig, er kunnen drie waterstof-ionen worden afgestaan, terwijl porfyrines tweewaardig zijn.
- De hoge waardigheid van corrolen als ligand heeft tot gevolg dat in metaal-complexen corrolen vaak niet-innocente liganden zijn, waarbij het corrool als radicaal-dianion voorkomt.[2]
- Een ander belangrijk verschil wordt gevormd door het feit dat de ringgrootte van de centrale ruimte in corrolen 17 atomen telt, in porfyrines zijn dit er 18.
Coördinatieverbindingen
Van corrolen is een groot aantal coördinatieverbindingen met zowel overgangsmetalen,[1][3] hoofdgroepelementen,[4] lanthanides,[5] als actinides beschreven.[6] Ook het dubbel geprotoneerde, neutrale corrool-radicaal is bestudeerd.[7]
Toepassingen
Corrolen en hun metaal-complexen zijn bruikbaar gebleken als markeerstoffen bij de opsporing van tumoren,[8] zuurstof-detectie en meting,[9] en als preventief middel bij hartziekten.[10] In de synthetische chemie zijn corroles met succes ingezet als als drager voor oxo-, imido-, and nitrido-groepen,[11] en als katalysator in de reductie van zuurstof naar water,[12] zowel als de productie van waterstof uit water onder aerobe omstandigheden.
Aan eiwitten gekoppelde corrolen zijn onderzocht als drager van theranoses in de detectie en behandeling van tumoren.[13]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Corrole op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b Orłowski, Rafał; Gryko, Dorota; Gryko, Daniel T. (2017). Synthesis of Corroles and Their Heteroanalogs. Chemical Reviews 117 (4), pag.: 3102–3137. PMID: 27813401. DOI: 10.1021/acs.chemrev.6b00434.
- ↑ Thomas, Kolle E.; Alemayehu, Abraham B.; Conradie, Jeanet; Beavers, Christine M.; Ghosh, Abhik (21 augustus 2012). The Structural Chemistry of Metallocorroles: Combined X-ray Crystallography and Quantum Chemistry Studies Afford Unique Insights. Accounts of Chemical Research 45 (8), pag.: 1203–1214. ISSN: 0001-4842. PMID: 22444488. DOI: 10.1021/ar200292d.
- ↑ Ghosh, Abhik (22 februari 2017). Electronic Structure of Corrole Derivatives: Insights from Molecular Structures, Spectroscopy, Electrochemistry, and Quantum Chemical Calculations. Chemical Reviews 117 (4), pag.: 3798–3881. ISSN: 0009-2665. PMID: 28191934. DOI: 10.1021/acs.chemrev.6b00590.
- ↑ Aviv-Harel, I.; Gross, Z. (2010). Coordination chemistry of corroles with focus on main group elements. Coord. Chem. Rev. 255 (7–8), pag.: 717–736. DOI: 10.1016/j.ccr.2010.09.013.
- ↑ Buckley, H. L.; Anstey, M. R.; Gryko, D. T.; Arnold, J. (2013). Lanthanide corroles: a new class of macrocyclic lanthanide complexes. Chem. Commun. 49 (30), pag.: 3104–3106. PMID: 23467462. DOI: 10.1039/c3cc38806a.
- ↑ Ward, A. L.; Buckley, H. L.; Lukens, W. W.; Arnold, J. (2013). Synthesis and Characterization of Thorium(IV) and Uranium(IV) Corrole Complexes. J. Am. Chem. Soc. 135 (37), pag.: 13965–13971. PMID: 24004416. DOI: 10.1021/ja407203s.
- ↑ Schweyen P, Brandhorst K, Wicht R, Wolfram B, Bröring M (2015). The Corrole Radical. Angew. Chem. Int. Ed. 54 (28), pag.: 8213–8216. PMID: 26074281. DOI: 10.1002/anie.201503624.
- ↑ Teo, Ruijie D.; Hwang, Jae Youn; Termini, John; Gross, Zeev; Gray, Harry B. (2017). Fighting Cancer with Corroles. Chemical Reviews 117 (4), pag.: 2711–2729. PMID: 27759377. PMC: 6357784. DOI: 10.1021/acs.chemrev.6b00400.
- ↑ (en) Borisov, Sergey M.; Alemayehu, Abraham; Ghosh, Abhik (2016). Osmium-nitrido corroles as NIR indicators for oxygen sensors and triplet sensitizers for organic upconversion and singlet oxygen generation. Journal of Materials Chemistry C 4 (24), pag.: 5822–5828. ISSN: 2050-7534. DOI: 10.1039/C6TC01126H.
- ↑ Haber, Adi; Ali, A. A.-Y.; Aviram, M.; Gross, Z. (2013). Allosteric inhibitors of HMG-CoA reductase, the key enzyme involved in cholesterol biosynthesis. Chem. Commun. 49 (93), pag.: 10917–10919. PMID: 23958894. DOI: 10.1039/c3cc44740e.
- ↑ Palmer, J. H. (2012). Molecular Electronic Structures of Transition Metal Complexes I. DOI:10.1007/430_2011_52, "Transition Metal Corrole Coordination Chemistry", 49–90. ISBN 978-3-642-27369-8.
- ↑ Dogutan, D. K.; Stoian, S. A.; McGuire, R.; Schwalbe, M.; Teets, T. S.; Nocera, D. G. (2011). Hangman Corroles: Efficient Synthesis and Oxygen Reaction Chemistry. J. Am. Chem. Soc. 133 (1), pag.: 131–140. PMID: 21142043. DOI: 10.1021/ja108904s.
- ↑ Teh, James, Kauwe, Lali Medina (2021). Metal Ions in Bio-Imaging Techniques. Springer. DOI:10.1515/9783110685701-016, "Chapter 10. Magnetic Resonance Contrast Enhancement and Therapeutic Properties of Corrole Nanoparticles", 299–314.