M-cel
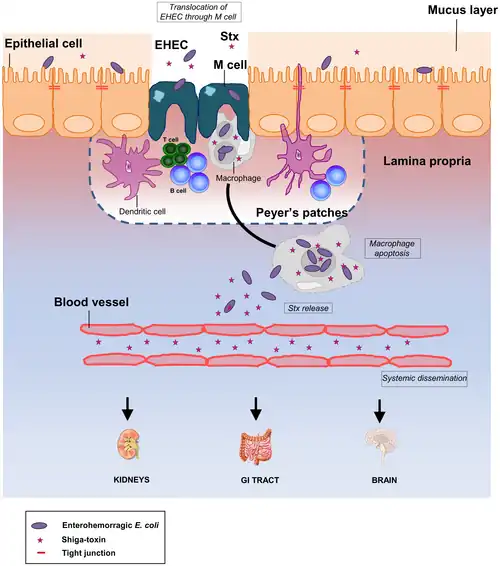
M-cellen of microfoldcellen worden aangetroffen in het darmgeassocieerd lymfoïd weefsel (GALT) van de amandelen en van de peyerse platen in de dunne darm en in het mucosa-geassocieerd lymfoïd weefsel (MALT) van de kronkeldarm. MALT bestaat uit lymfocyten zoals T-cellen en B-cellen, maar ook uit plasmacellen, dendritische cellen en macrofagen. M-cellen zijn allemaal goed gepositioneerd om antigenen tegen te komen die door het slijmvliesepitheel heen dringen. Mo-cellen worden ook wel M-cellen genoemd, maar die moeten niet verward worden met deze M-cellen.
De M-cellen ontstaan waarschijnlijk uit stamcellen in de crypten, net als de rest van het darmepitheel. Cel-celcontacten, waaronder die met B-cellen, spelen waarschijnlijk een rol bij de differentiatie. In het follikelgeassocieerd epitheel (FAE) van alle amandelen komen extra M-cellen voor, samen met langerhanscellen.
De M-cellen initiëren mucosale immuunreacties op het apicale membraan van de M-cellen en transport van micro-organismen en deeltjes door de epitheelcellaag van het darmlumen naar de lamina propria mogelijk maken, waar interacties met immuuncellen kunnen plaatsvinden.[1]
In tegenstelling tot hun buurcellen hebben M-cellen het unieke vermogen om antigeen op te nemen uit het lumen van de dunne darm via endocytose, fagocytose of transcytose. Antigenen worden afgeleverd aan antigeenpresenterende cellen, zoals dendritische cellen en B-lymfocyten. M-cellen brengen het protease cathepsine E tot expressie, vergelijkbaar met andere antigeenpresenterende cellen. Dit proces vindt plaats in een unieke zakachtige structuur aan hun basolaterale zijde van de M-cel. Antigenen worden herkend via de expressie van celoppervlakreceptoren zoals glycoproteïne-2 (GP2), die bacteriën detecteren en er specifiek aan binden. Cellulair prioneiwit (PrP) is een ander voorbeeld van een celoppervlakreceptor op M-cellen.[2]
M-cellen hebben geen microvilli, maar worden, net als andere epitheelcellen, gekenmerkt door sterke celverbindingen. Dit vormt een fysieke barrière die een belangrijke verdedigingslinie vormt tussen de darminhoud en het immuunsysteem van de gastheer. Ondanks de epitheelbarrière kunnen sommige antigenen de M-celbarrière infiltreren en nabijgelegen epitheelcellen infecteren of de darm binnendringen.[3]
Morfologie
M-cellen onderscheiden zich van andere intestinale epitheelcellen door hun morfologische verschillen. Ze worden gekenmerkt door hun korte microvilli aan de apicale zijde (richting het darmlumen) of het ontbreken van deze uitsteeksels op het celoppervlak. Wanneer ze microvilli vertonen, zijn ze kort, onregelmatig en bevinden ze zich op het apicale oppervlak (richting het darmlumen) of in een zakvormige invaginatie op het basolaterale oppervlak (aan de basis en aan de zijkant liggend) van deze cellen. Wanneer ze geen microvilli hebben, worden ze gekenmerkt door hun microplooien en krijgen ze daarom hun algemeen bekende naam. De basale zijde van de M-cellen (weg van het darmlumen) wordt gekenmerkt door verschillende inkepingen. Via deze inkepingen staan de T- en B-lymfocyten van de peyerse platen, maar ook dendritische cellen en macrofagen in nauw contact met de M-cellen.
Deze cellen komen veel minder voor dan enterocyten. Ze kunnen ook worden herkend aan de hand van cytoskelet- en extracellulaire matrixcomponenten die tot expressie komen aan de rand van cellen of op hun celoppervlak, zoals actine, villine, cytokeratine en vimentine.[3]
Ontwikkeling
Factoren die de differentiatie van M-cellen bevorderen, moeten nog worden opgehelderd, maar men denkt dat ze zich ontwikkelen als reactie op signalen van immuuncellen die worden aangetroffen in de zich ontwikkelende peyerse platen.[4] B-cellen zijn betrokken bij de ontwikkeling van M-cellen, omdat ze ook in grote aantallen gelokaliseerd zijn in het follikelgeassocieerd epitheel (FAE). Ongeveer 10–15% van het oppervlak van het follikel-geassocieerde epitheel wordt gevormd door M-cellen. Een gebrek aan B-celpopulaties bij FAE resulteert in een afname van het aantal M-cellen dat de peyerse platen bekleedt. Evenzo is bekend dat een menselijke lymfoomcellijn ook een transitie ondergaat van adenocarcinoomcellen naar M-cellen.
Hoewel veel studies hebben aangetoond dat verschillende celtypen de differentiatie van M-cellen sturen, karakteriseert nieuw onderzoek de moleculaire routes die de M-celdifferentiatie sturen. Meer recent is, door middel van loss-of-function- en rescue-fenotype-studies, aangetoond dat RANKL (Receptor activator of nuclear factor kappa-Β ligand) een receptoractivator is van de NF-κB-ligand en een rol speelt in de differentiatie van M-cellen. RANKL wordt in de hele dunne darm tot expressie gebracht, vergemakkelijkt de opname van pathogenen zoals Salmonella en is de meest kritische factor in de M-celdifferentiatie.[5] Microben die op het darmepitheel worden aangetroffen, staan erom bekend de ontwikkeling van M-cellen te sturen. Het type 3 secretiesysteem-effector-eiwit SopB activeert bijvoorbeeld de epitheliale-mesenchymale overgang (EMT) van enterocyten naar M-cellen.[6] M-cellen ondergaan het differentiatieproces tot vier dagen voordat ze volledig rijp zijn. Recente studies hebben gesuggereerd dat ze zich duidelijk onderscheiden van de lymfoïde en myeloïde lijnen.[7]
Pathogenen kunnen gebruikmaken van celdifferentiatiepaden om gastheercellen binnen te dringen. Dit gebeurt door de differentiatie van enterocyten naar het M-celtype in het darmepitheel te induceren.[1] In één geval wordt het hierboven genoemde SopB-effectoreiwit afgescheiden om snelle differentiatie van enterocyten in het follikelgeassocieerd epitheel te activeren door de overgang van epitheel naar mesenchym in deze cellen te initiëren. Wanneer SopB de differentiatie van enterocyten activeert, werkt het via de activering van het Wnt/β-catenine-signalringspad en triggert het de RANKL en zijn receptor, die betrokken zijn bij de regulering van celapoptose.[6]
Functie

M-cellen spelen een belangrijke rol in de werking van het MALT-systeem (Mucosa Associated Lymphoid Tissue), waartoe ook de peyerse platen behoren, en daarmee ook in het immuunsysteem. Ze scheiden geen slijm of spijsverteringsenzymen af en hebben een dunnere glycocalyx, waardoor ze gemakkelijk toegang hebben tot het darmlumen voor endocytose van antigenen. De M-cellen nemen aan hun apicale zijde antigenen op. De antigenen die M-cellen kunnen absorberen zijn onder andere macromoleculen, bacteriën, virussen en kleinere parasieten. De antigenen worden aan de basale zijde naar de cellen van het adaptieve immuunsysteem getransporteerd. Het precieze mechanisme is nog niet duidelijk. Het is bovendien onduidelijk of de verwerking van de antigenen in de M-cellen plaatsvindt en of en hoe de antigenen aan de effectorcellen van het immuunsysteem worden gepresenteerd. Blijkbaar wordt een groot deel van de apicaal opgenomen antigenen onverwerkt via vesiculair transport naar de basale regio getransporteerd en door exocytose vrijgegeven.
De belangrijkste functie van M-cellen is de selectieve endocytose van antigenen en het transporteren ervan naar intra-epitheliale macrofagen en lymfocyten, die vervolgens migreren naar lymfeklieren waar een immuunreactie kan worden geïnitieerd.[8]
De oraal toegediende vaccins worden ook via de M-cellen in het lichaam opgenomen.
Passieve immuniteit
M-cellen spelen een rol in passieve immuniteit, oftewel de overdracht van actieve humorale immuniteit tijdens en na de zwangerschap. Baby's zijn afhankelijk van antilichamen die specifiek zijn voor de intestinale antigenen van hun moeder. Deze antilichamen verplaatsen zich vanuit de darmen van de moeder naar de moedermelk. Deze antilichamen kunnen via het lymfestelsel in de melkproductie terechtkomen. Hoewel het mechanisme van dit transport nog niet volledig begrepen is, wordt verondersteld dat dendritische cellen en macrofagen de rol van transporteur spelen. Bij vrouwen die geen borstvoeding geven, stimuleren M-cellen, wanneer ze antigeen in de darmen herkennen, de productie van veel immunoglobuline A (IgA)-antilichamen. Deze antilichamen komen vrij in het darmslijmvlies, de speekselklieren en de lymfeklieren. Bij vrouwen die borstvoeding geven, herkennen M-cellen echter antigeen en wordt IgA vanuit de darmen naar de melkklier geleid. De IgA-stroom vanuit de darmen naar de moedermelk wordt gereguleerd door hormonen, chemokines en cytokines. De melkklier en de moedermelk spelen dus naast M-cellen een cruciale rol in het mucosale immuunsysteem.[9]
Klinische betekenis
M-cellen worden gebruikt door verschillende pathogene gramnegatieve bacteriën, waaronder Shigella flexneri, Salmonella typhimurium en Yersinia pseudotuberculosis, evenals door infectieuze prionen, zoals bij boviene spongiforme encefalopathie (gekkekoeienziekte), om door het darmepitheel te dringen. Exploitatie als een virulentiefactor is afhankelijk van het vermogen van de ziekteverwekker om zich aan M-cellen te binden en zo penetratie van het darmepitheel op die manier te garanderen, aangezien M-cellen de darminhoud bemonsteren. EPEC (pathogeen Escherichia coli) bevattende plasmiden met genen voor EAF (Escherichia coli-adhesiefactor) voor het zich hechten aan M-cellen. Ze worden ook gebruikt door virussen zoals polio en reovirus voor verspreiding.[10] CXCR4-tropisch, maar niet CCR5-tropisch hiv blijkt zich aan M-cellen te kunnen binden en door hen heen door het epitheel te worden getransporteerd.[11]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Microfold cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Mabbott NA, Donaldson DS, Ohno H, Williams IR, Mahajan A (July 2013). Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology 6 (4): 666–677. PMID 23695511. PMC 3686595. DOI: 10.1038/mi.2013.30.
- ↑ Miller H, Zhang J, Kuolee R, Patel GB, Chen W (March 2007). Intestinal M cells: the fallible sentinels?. World Journal of Gastroenterology 13 (10): 1477–1486. PMID 17461437. PMC 1876659. DOI: 10.3748/wjg.v13.i10.1477.
- ↑ a b Kanaya T, Ohno H (2014). The Mechanisms of M-cell Differentiation. Bioscience of Microbiota, Food and Health 33 (3): 91–97. PMID 25032083. PMC 4098651. DOI: 10.12938/bmfh.33.91.
- ↑ Kraehenbuhl JP, Neutra MR (2000). Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology 16: 301–332. PMID 11031239. DOI: 10.1146/annurev.cellbio.16.1.301. Link
- ↑ Knoop KA, Kumar N, Butler BR, Sakthivel SK, Taylor RT, Nochi T, Akiba H, Yagita H, Kiyono H, Williams IR (November 2009). RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology 183 (9): 5738–5747. PMID 19828638. PMC 2922944. DOI: 10.4049/jimmunol.0901563.
- ↑ a b Tahoun A, Mahajan S, Paxton E, Malterer G, Donaldson DS, Wang D, Tan A, Gillespie TL, O'Shea M, Roe AJ, Shaw DJ, Gally DL, Lengeling A, Mabbott NA, Haas J, Mahajan A (November 2012). Salmonella transforms follicle-associated epithelial cells into M cells to promote intestinal invasion. Cell Host & Microbe 12 (5): 645–656. PMID 23159054. DOI: 10.1016/j.chom.2012.10.009.
- ↑ Ohno H, Kanaya T, Williams IR (November 2012). M cell differentiation: distinct lineage or phenotypic transition? Salmonella provides answers. Cell Host & Microbe 12 (5): 607–609. PMID 23159049. DOI: 10.1016/j.chom.2012.11.003.
- ↑ Murphy KM (2012). Janeway's Immunobiology, 8th. Garland Science, New York. ISBN 978-0-8153-4243-4.
- ↑ (en) Milligan L, From Mother's Gut to Milk. International Milk Genomics Consortium (April 2013). Geraadpleegd op 20 februari 2019.
- ↑ Ouzilou L, Caliot E, Pelletier I, Prévost MC, Pringault E, Colbère-Garapin F (September 2002). Poliovirus transcytosis through M-like cells. The Journal of General Virology 83 (Pt 9): 2177–2182. PMID 12185271. DOI: 10.1099/0022-1317-83-9-2177.
- ↑ Fotopoulos G, Harari A, Michetti P, Trono D, Pantaleo G, Kraehenbuhl JP (July 2002). Transepithelial transport of HIV-1 by M cells is receptor-mediated. Proceedings of the National Academy of Sciences of the United States of America 99 (14): 9410–9414. PMID 12093918. PMC 123154. DOI: 10.1073/pnas.142586899.