Vimentine
_%D1%84%D1%96%D0%B1%D1%80%D0%BE%D0%B1%D0%BB%D0%B0%D1%81%D1%82%D1%96%D0%B2_%D1%81%D0%B5%D1%80%D1%86%D1%8F_%D1%89%D1%83%D1%80%D0%B0.jpg)
Vimentine is een structureel eiwit dat bij mensen wordt gecodeerd door het VIM-gen. De naam komt van het Latijnse vimentum, wat verwijst naar een reeks flexibele staafjes.[1]
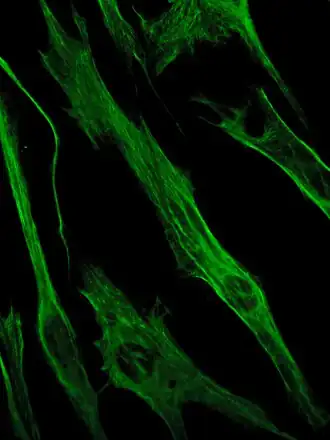
Vimentine is een type III intermediair filament (IF)-eiwit dat tot expressie komt in mesenchymcellen. IF-eiwitten worden aangetroffen in alle dierlijke cellen,[2] evenals in bacteriën.[3] Intermediaire filamenten vormen samen met tubuline-gebaseerde microtubuli en actine-gebaseerde microfilamenten het cytoskelet. Alle IF-eiwitten worden tot expressie gebracht op een sterk ontwikkelingsgereguleerde manier; vimentine is de belangrijkste cytoskeletcomponent van mesenchymcellen. Daarom wordt vimentine vaak gebruikt als marker voor mesenchymaal afgeleide cellen of cellen die een epitheliale-mesenchymale overgang (EMT) ondergaan, zowel tijdens de normale ontwikkeling als tijdens metastatische progressie.
Structuur
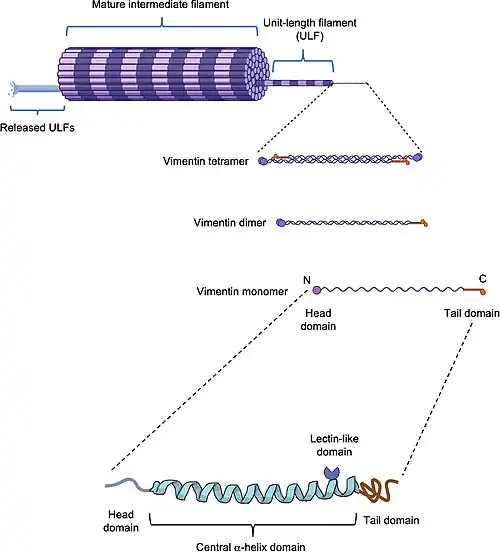
De opbouw van het vezelige vimentinefilament dat het cytoskelet vormt, verloopt geleidelijk. Het vimentinemonomeer heeft een centraal α-helixdomein, aan beide uiteinden afgesloten door niet-helixaminodomeinen (kop) en carboxyldomeinen (staart).[4] Twee monomeren worden waarschijnlijk cotranslationeel tot expressie gebracht op een manier die hun interactie vergemakkelijkt en een coiled-coil dimeer vormt, de basiseenheid van de vimentine-opbouw.[5] Een paar coiled-coil dimeren verbindt zich op antiparallelle wijze tot een tetrameer. Acht tetrameren voegen zich samen tot wat bekend staat als het unit-length filament (ULF). ULF's hechten zich vervolgens aan elkaar en verlengen zich, gevolgd door verdichting om de vezelige eiwitten te vormen.[6]
De α-helixsequenties bevatten een patroon van hydrofobe aminozuren die bijdragen aan de vorming van een "hydrofobe afdichting" op het oppervlak van de helix.[4] Bovendien is er een periodieke verdeling van zure en basische aminozuren die een belangrijke rol lijkt te spelen bij het stabiliseren van coiled-coil-dimeren.[4] De afstand tussen de geladen residuen is optimaal voor ionische zoutbruggen, wat de stabilisatie van de α-helixstructuur mogelijk maakt. Hoewel dit type stabilisatie intuïtief is voor interacties binnen de keten, in plaats van interacties tussen de ketens, hebben wetenschappers voorgesteld dat de overstap van zoutbruggen binnen de keten, gevormd door zure en basische residuen, naar de ionaire bindingen tussen de ketens wellicht bijdraagt aan de vorming van het filament.[4] Een zoutbrug is een combinatie van twee niet-covalente bindingen: waterstofbruggen en ionaire bindingen.
Functie
Vimentine speelt een belangrijke rol bij het ondersteunen en verankeren van de positie van de organellen in het cytosol. Vimentine is lateraal of terminaal verbonden met de celkern, het endoplasmatisch reticulum en de mitochondriën.[7]
De dynamische aard van vimentine is belangrijk om de cel flexibiliteit te bieden. Wetenschappers ontdekten dat vimentine cellen een veerkracht gaf die ontbrak in de microtubuli- of actinefilamentnetwerken, wanneer ze in vivo onder mechanische spanning stonden. Daarom wordt in het algemeen aangenomen dat vimentine de cytoskeletcomponent is die verantwoordelijk is voor het behoud van de celintegriteit. (Er werd vastgesteld dat cellen zonder vimentine extreem kwetsbaar zijn wanneer ze worden verstoord met een micropunctie)..[8] Transgene muizen zonder vimentine leken normaal en vertoonden geen functionele verschillen.[9] Het is mogelijk dat het microtubulinetwerk de afwezigheid van het intermediaire netwerk compenseerde. Deze resultaten ondersteunen een nauwe interactie tussen microtubuli en vimentine. Bovendien vond er een reorganisatie van vimentine plaats wanneer microtubuli-depolymerisatoren aanwezig waren, wat opnieuw duidt op een relatie tussen de twee systemen.[8] Aan de andere kant genezen gewonde muizen die het vimentine-gen missen langzamer dan hun wildtype tegenhangers.[10]
Vimentine is in essentie verantwoordelijk voor het behoud van de celvorm, de integriteit van het cytoplasma en de stabilisatie van cytoskeletinteracties. Vimentine blijkt toxische eiwitten te elimineren in JUNQ- en IPOD-insluitlichaampjes bij asymmetrische deling van zoogdiercellijnen.[11] JUNQ en IPOD zijn typen cytosolische proteïne-insluitlichaampjes in eukaryoten.
Ook blijkt vimentine het transport van cholesterol, afkomstig van LDL (lagedichtheidlipoproteïne), van een lysosoom naar de veresteringsplaats te reguleren..[12] Door het transport van LDL-afgeleid cholesterol binnen de cel te blokkeren, bleken cellen een veel lager percentage van het lipoproteïne op te slaan dan normale cellen met vimentine. Deze afhankelijkheid lijkt het eerste proces te zijn van een biochemische functie in elke cel die afhankelijk is van een cellulair intermediair filamentnetwerk. Dit type afhankelijkheid heeft gevolgen voor de bijniercellen, die afhankelijk zijn van cholesterolesters afkomstig van LDL.[12]
Vimentine speelt een rol bij de vorming van agressieve stoffen, waar het een kooi vormt rond een kern van geaggregeerd eiwit.[13]
Naast de conventionele intracellulaire lokalisatie kan vimentine ook extracellulair worden aangetroffen. Vimentine kan tot expressie worden gebracht als een membraanreceptor en zou een rol kunnen spelen bij immuunreacties. Het kan ook in gefosforyleerde vorm worden afgegeven aan de extracellulaire ruimte door geactiveerde macrofagen; astrocyten staan er ook om bekend vimentine af te geven.[14]
Klinische betekenis
Het is gebruikt als een sarcoom-tumormarker om mesenchym te identificeren.[15][16] De specificiteit ervan als biomarker is betwist door Jerad Gardner.[17] Vimentine is aanwezig in spindelcel-plaveiselcelcarcinoom.[18][19]
Methylering van het vimentine-gen is vastgesteld als een biomarker voor darmkanker en dit wordt gebruikt bij de ontwikkeling van fecale tests voor darmkanker. Statistisch significante niveaus van methylering van het vimentine-gen zijn ook waargenomen bij bepaalde aandoeningen van het bovenste deel van het maag-darmkanaal, zoals de Barrettoesofagus, slokdarmkanker en intestinale maagkanker.[20] Hoge niveaus van DNA-methylering in de promotorregio zijn ook in verband gebracht met een aanzienlijk verminderde overleving bij hormoonpositieve borstkanker.[21] Downregulatie van vimentine werd vastgesteld in de cystische variant van papillair schildkliercarcinoom met behulp van een proteomische benadering.[26] Zie ook antistoffen tegen cyclische, gecitrullineerde peptiden voor het gebruik ervan bij de diagnose van reumatoïde artritis.
Vimentine werd door Nader Rahimi en collega's ontdekt als een aanhechtingsfactor voor SARS-CoV-2.[22]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Vimentin op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Franke WW, Schmid E, Osborn M, Weber K (October 1978). Different intermediate-sized filaments distinguished by immunofluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America 75 (10): 5034–5038. PMID 368806. PMC 336257. DOI: 10.1073/pnas.75.10.5034.
- ↑ Eriksson JE, Dechat T, Grin B, Helfand B, Mendez M, Pallari HM, Goldman RD (July 2009). Introducing intermediate filaments: from discovery to disease. The Journal of Clinical Investigation 119 (7): 1763–1771. PMID 19587451. PMC 2701876. DOI: 10.1172/JCI38339.
- ↑ Cabeen MT, Jacobs-Wagner C (2010). The bacterial cytoskeleton. Annual Review of Genetics 44: 365–392. PMID 21047262. DOI: 10.1146/annurev-genet-102108-134845.
- ↑ a b c d Fuchs E, Weber K (1994). Intermediate filaments: structure, dynamics, function, and disease. Annual Review of Biochemistry 63: 345–382. PMID 7979242. DOI: 10.1146/annurev.bi.63.070194.002021.
- ↑ Chang L, Shav-Tal Y, Trcek T, Singer RH, Goldman RD (February 2006). Assembling an intermediate filament network by dynamic cotranslation. The Journal of Cell Biology 172 (5): 747–758. PMID 16505169. PMC 2063706. DOI: 10.1083/jcb.200511033.
- ↑ Danielsson F, Peterson MK, Caldeira Araújo H, Lautenschläger F, Gad AK (September 2018). Vimentin Diversity in Health and Disease. Cells 7 (10): 147. PMID 30248895. PMC 6210396. DOI: 10.3390/cells7100147.
- ↑ Katsumoto T, Mitsushima A, Kurimura T (1990). The role of the vimentin intermediate filaments in rat 3Y1 cells elucidated by immunoelectron microscopy and computer-graphic reconstruction. Biology of the Cell 68 (2): 139–146. PMID 2192768. DOI: 10.1016/0248-4900(90)90299-I.
- ↑ a b Goldman RD, Khuon S, Chou YH, Opal P, Steinert PM (August 1996). The function of intermediate filaments in cell shape and cytoskeletal integrity. The Journal of Cell Biology 134 (4): 971–983. PMID 8769421. PMC 2120965. DOI: 10.1083/jcb.134.4.971.
- ↑ Colucci-Guyon E, Portier MM, Dunia I, Paulin D, Pournin S, Babinet C (November 1994). Mice lacking vimentin develop and reproduce without an obvious phenotype. Cell 79 (4): 679–694. PMID 7954832. DOI: 10.1016/0092-8674(94)90553-3.
- ↑ Eckes B, Colucci-Guyon E, Smola H, Nodder S, Babinet C, Krieg T, Martin P (July 2000). Impaired wound healing in embryonic and adult mice lacking vimentin. Journal of Cell Science 113 (13): 2455–2462. PMID 10852824. DOI: 10.1242/jcs.113.13.2455.
- ↑ Ogrodnik M, Salmonowicz H, Brown R, Turkowska J, Średniawa W, Pattabiraman S, Amen T, Abraham AC, Eichler N, Lyakhovetsky R, Kaganovich D (June 2014). Dynamic JUNQ inclusion bodies are asymmetrically inherited in mammalian cell lines through the asymmetric partitioning of vimentin. Proceedings of the National Academy of Sciences of the United States of America 111 (22): 8049–8054. PMID 24843142. PMC 4050583. DOI: 10.1073/pnas.1324035111.
- ↑ a b Sarria AJ, Panini SR, Evans RM (September 1992). A functional role for vimentin intermediate filaments in the metabolism of lipoprotein-derived cholesterol in human SW-13 cells. The Journal of Biological Chemistry 267 (27): 19455–19463. PMID 1527066. DOI: 10.1016/S0021-9258(18)41797-8.
- ↑ Johnston JA, Ward CL, Kopito RR (December 1998). Aggresomes: a cellular response to misfolded proteins. The Journal of Cell Biology 143 (7): 1883–1898. PMID 9864362. PMC 2175217. DOI: 10.1083/jcb.143.7.1883.
- ↑ Paulin D, Lilienbaum A, Kardjian S, Agbulut O, Li Z (June 2022). Vimentin: Regulation and pathogenesis. Biochimie 197: 96–112. PMID 35151830. DOI: 10.1016/j.biochi.2022.02.003.
- ↑ Leader M, Collins M, Patel J, Henry K (January 1987). Vimentin: an evaluation of its role as a tumour marker. Histopathology 11 (1): 63–72. PMID 2435649. DOI: 10.1111/j.1365-2559.1987.tb02609.x.
- ↑ Immunohistochemistry from the Washington Animal Disease Diagnostic laboratory (WADDL)of the College of Veterinary Medicine, Washington State University. Gearchiveerd op 1 december 2008. Geraadpleegd op 14 maart 2009.
- ↑ Gardner J, How to Interpret Vimentin Immunostain. YouTube (23 september 2010). Gearchiveerd op 12 december 2021.
- ↑ Dotto JE, Glusac EJ (June 2006). p63 is a useful marker for cutaneous spindle cell squamous cell carcinoma. Journal of Cutaneous Pathology 33 (6): 413–417. PMID 16776716. DOI: 10.1111/j.0303-6987.2006.00477.x.
- ↑ Barrette K, Van Kelst S, Wouters J, Marasigan V, Fieuws S, Agostinis P, van den Oord J, Garmyn M (November 2014). Epithelial-mesenchymal transition during invasion of cutaneous squamous cell carcinoma is paralleled by AKT activation. The British Journal of Dermatology 171 (5): 1014–1021. PMID 24628329. DOI: 10.1111/bjd.12967.
- ↑ Moinova H, Leidner RS, Ravi L, Lutterbaugh J, Barnholtz-Sloan JS, Chen Y, Chak A, Markowitz SD, Willis JE (April 2012). Aberrant vimentin methylation is characteristic of upper gastrointestinal pathologies. Cancer Epidemiology, Biomarkers & Prevention 21 (4): 594–600. PMID 22315367. PMC 3454489. DOI: 10.1158/1055-9965.EPI-11-1060.
- ↑ Ulirsch J, Fan C, Knafl G, Wu MJ, Coleman B, Perou CM, Swift-Scanlan T (January 2013). Vimentin DNA methylation predicts survival in breast cancer. Breast Cancer Research and Treatment 137 (2): 383–396. PMID 23239149. PMC 3838916. DOI: 10.1007/s10549-012-2353-5.
- ↑ Amraei R, Xia C, Olejnik J, White MR, Napoleon MA, Lotfollahzadeh S, Hauser BM, Schmidt AG, Chitalia V, Mühlberger E, Costello CE, Rahimi N (February 2022). Extracellular vimentin is an attachment factor that facilitates SARS-CoV-2 entry into human endothelial cells. Proceedings of the National Academy of Sciences of the United States of America 119 (6). PMID 35078919. PMC 8833221. DOI: 10.1073/pnas.2113874119. e2113874119.