L-cel

Enteroendocriene L-cellen, GLP-1-cellen, PYY-cellen of neuropodcellen scheiden glucagon-achtige peptide-1 (GLP-1) uit, een incretine, peptide YY3-36, oxyntomoduline en glucagon-achtige peptide-2. L-cellen worden voornamelijk aangetroffen in de kronkeldarm en de dikke darm (colon), maar sommige worden ook aangetroffen in de twaalfvingerige darm en nuchtere darm.[1]
Ze zijn in staat synaptische verbindingen te maken met sensorische zenuwen.[2][3]
Anatomie
De naam L-cel is te danken aan een vroege classificatie, morfologisch (grote granula (korrels), Lg-cel, L-cel) en biochemisch (gedetecteerd peptide PYY).[3] Menselijke L-cellen worden op een verspreide manier aangetroffen in het maag-darmstelsel tussen de cellen van het darmepitheel die het slijmvlies vormen en zijn het talrijkst in de kronkeldarm en de dikke darm.[2] L-cellen zijn kegelvormig, waarbij de basis rust op het basale membraan van het darmepitheel. De hormoonbevattende granula (korrels) bevinden zich aan de basolaterale zijde tegenover de haarvaten. Bij varkens en alpaca's worden deze cellen in grote aantallen aangetroffen in het distale gedeelte van de nuchtere darm en de kronkeldarm. Bij ratten bevindt de hoogste celdichtheid zich in de kronkeldarm.[4]
Lichtmicroscopische structuur
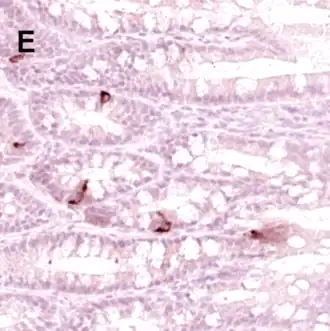
Onder een lichtmicroscoop en met standaardkleuring verschijnen L-cellen als heldere cellen. Chroom- en zilverkleuring zorgden voor een betere visualisatie en onthulden de aanwezigheid van intracytoplasmatische granula (korrels}. Met technieken die generieke cellulaire producten detecteren, zoals chromogranine, een proteïne dat geassocieerd is met secretiegranula, en synaptofysine, is het mogelijk de endocriene aard van de L-cellen vast te stellen.
Meer specifiek gaat het om het gebruik van antilichamen gericht tegen hormonale stoffen; Immunohistochemie kan elk van de peptiden in de korrels van de L-cel afzonderlijk markeren.[5] L/PYY-cellen hebben een langwerpige fles- of kolfvorm met een lengte tot 70 µm en vertonen een zeer duidelijke celpolariteit, met één uiteinde in het lumen van de darm en het andere in de lamina propria. Cytoplasmatische korrels die hormonen bevatten zoals PYY en GLP-1 werden door middel van immunohistochemie gelokaliseerd, waarbij ze geconcentreerd voorkomen in de verwijde basis van de cel.[6]
Enteroendocriene L-cellen zijn van het ‘open type’: met één uiteinde in het lumen van de darm en het andere in de lamina propria.[7]
Elektronenmicroscopische structuur
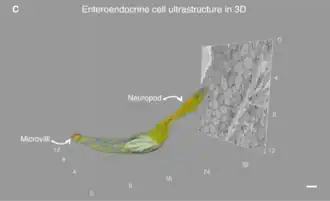
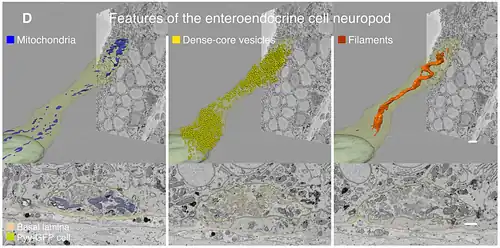
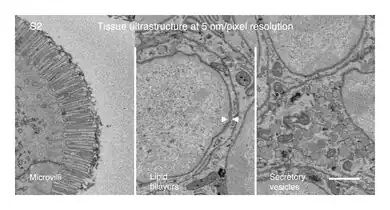
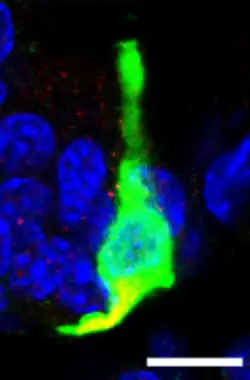
Met behulp van elektronenmicroscopie konden L/PYY-cellen worden geclassificeerd op basis van hun ultrastructurele morfologie, gekenmerkt door grote, ronde korrels van 350 nm en een elektronendicht centrum, typisch voor hormoonopslag.[3][7] Op lumenniveau hebben de L-cellen karakteristieke korte en schaarse microvilli die in contact staan met de darminhoud. Aan het andere uiteinde, ter hoogte van de lamina propria, is de basis van de L/PYY-cel niet groter dan 10 µm in diameter en vertoont een lange cytoplasmatische uitloper, die een neuropode wordt genoemd. De neuropode loopt onder de aangrenzende enterocyten en kan een lengte bereiken van 70 µm. [8] Deze lange neuropoden zijn gevuld met mitochondriën, grote, dichte secretoire vesikels die hormonen bevatten, en andere kleine, heldere vesikels waarvan wordt gedacht dat ze neurotransmitters bevatten.[2]
De L-cellen in de kronkeldarm zien er anatomisch anders uit dan die in de dikke darm. De L-cellen in de kronkeldarm hebben een vorm die lijkt op de letter L, terwijl die in de dikke darm een spoelvormige of sigmoïde vorm hebben.[6]
Functies
L-cellen hebben functies bij de motiliteit van het maag-darmstelsel en secretie, absorptie, lokale immuunverdediging, celproliferatie en eetlust.[9][2]
Gespecialiseerde microvilli aan het uiteinde van de L-cellen dat in het darmlumen steekt, fungeren als sensoren voor de inhoud van de darm, of het nu voedingsstoffen of bacteriële bijproducten zijn. Deze cellen reageren op de stimulus van de luminale inhoud door hun hormonen af te geven in de lamina propria, waar ze diffunderen in de haarvaten voor het bereiken van hun ververwijderd doel.[10]
Deze L-cellen vertonen enkele biochemische merkers van zenuwdifferentiatie, waaronder die welke betrokken zijn bij de biosynthese van neurotransmitters. Daarnaast hebben ze enkele elektronenmicroscopisch zichtbare eigenschappen die gemeenschappelijk zijn voor zenuwcellen.[11]
Eerder werd gedacht dat de transmissie van sensorische signalen van enteroendocriene cellen alleen op paracriene wijze plaatsvond, waarbij afgescheiden peptidehormonen door de lamina propria diffundeerden en in contact kwamen met intrinsieke of extrinsieke zenuwcellen, de bloedsomloop binnendrongen en/of inwerkten op specifieke doelweefsels.[12][13] Echter bij L-cellen, ontdekt door Dr. Diego V. Bohórquez in 2015 en later de naam neuropod bedacht in 2018, werd waargenomen dat ze synaptische verbindingen vormen met zenuwen in het slijmvlies van de dunne en dikke darm van knaagdieren.[14][15] Deze synapsen bleken zenuwcellen te omvatten die afkomstig zijn van de ganglion spinalia en de vagale nodose ganglia van het ruggenmerg, wat suggereerde dat sensorische informatie uit het darmlumen binnen milliseconden na activering naar de hersenen kon worden overgebracht.[15] Ook werd ontdekt dat deze L-cellen zowel pre- als postsynaptische eiwitten bevatten, wat suggereert dat informatie niet alleen aan zenuwcellen kan worden overgebracht, maar ook door hen kan worden ontvangen.[14][15][16]
Voedingsstoffenwaarneming en gedrag
Hoewel het bekend is dat er een relatie is tussen geconsumeerd voedsel, hongergevoel en lichamelijke gezondheid, zijn de mechanismen die ten grondslag liggen aan de darmperceptie van voedsel pas recentelijk ontdekt. Integraal aan deze waarneming van voedingsstoffen en de regulatie van de postprandiale fysiologie zijn enteroendocriene cellen.[17] Deze cellen zijn niet alleen in staat de voedingswaarde van ingenomen voedsel te beoordelen door glucose, vetzuren, aminozuren, monoacylglycerolen en oligopeptiden te detecteren, maar ze kunnen ook eetlustbeslissingen sturen.[17][18] Hoewel suiker en kunstmatige zoetstoffen een zoete smaak genereren, heeft natuurlijke suiker de voorkeur en kan deze zelfs van kunstmatige zoetstoffen worden onderscheiden door muizen die geen smaakreceptoren hebben.[19][20][21] Dit suggereert dat de darm niet alleen belangrijk is voor het onderscheid tussen de twee suikers, maar ook voor de voorkeur van het dier voor de natuurlijke suiker boven de kunstmatige zoetstof. Bij infusie van natuurlijke suiker of kunstmatige zoetstof in de dunne darm, gaven L-cellen van het duodenum luminale informatie door aan verschillende populaties vagale nodosezenuwcellen, hetzij via glutamaterge neurotransmissie (sacharose) of purinerge neurotransmissie (sucralose).[18] Bovendien werd de voorkeur van het dier voor sacharose boven sucralose tenietgedaan (90,8% tot 58,9% sacharosevoorkeur) na het gebruik van een flexibele glasvezelkabel (optogenetica) om L-cellen van de twaalfvingerige darm selectief tot zwijgen te brengen.[18] Deze gegevens suggereren dat L-cellen van de twaalfvingerige darm niet alleen in staat zijn om natuurlijke suiker van kunstmatige zoetstof te onderscheiden door gebruik te maken van verschillende neurotransmitters en door activering van verschillende zenuwpopulaties, maar dat ze ook in staat zijn om eetlust opwekkende voorkeuren voor de natuurlijke suiker aan te sturen.
Fysiologie
L-cellen detecteren en reageren op de producten van de vertering van koolhydraten, vetten en eiwitten door peptiden vrij te geven die in hun secretoire granulen (korrels) zitten.[22] L-cellen synthetiseren het 160 aminozuren tellende polypeptide pre-proglucagon, dat bij mensen wordt gecodeerd door het GCG-gen op chromosoom 2 2q24.2. Het van proglucagon afkomstige peptide is een voorloper van verschillende hormonale peptiden die door deze cellen worden afgescheiden. Tot de hormonale peptiden die door L-cellen worden geproduceerd, behoren glucagon-like peptide-1 (GLP-1) en glucagon-like peptide-2 (GLP-2).
Prikkelbaarheid
De L-cel is elektrisch prikkelbaar en gebruikt actiepotentialen om signalen te coderen en door te geven, die rechtstreeks de GLP-1-secretie moduleren. Het maakt gebruik van zijn actiepotentiaal om het signaal over te brengen, van zijn apicale uiteinde met microvilli, naar de basale pool waar de secretoire vesikels van de L-cel zich bevinden en zo de vrijgave van de hormonen die ze bevatten te bepalen.[22]
Secreties
De belangrijkste secretieproducten van de L-cellen, die paracriene en endocriene acties hebben, zijn de volgende vier.[23]
- Glucagon-achtige peptide 2 (GLP-2) (Enteroglucagon)
- Peptide YY (PYY)
- Oxyntomoduline (OXM), onderdrukt de eetlust
Microbiële interacties
Het is bekend dat de darmflora het immuunsysteem stimuleert en bijdraagt aan het behoud van een gezond centraal zenuwstelsel, wat uitgebreid is gedocumenteerd bij kiemvrije en gnotobiotische muizen die een overijverig immuunsysteem en een overvloed aan neurologische tekorten vertonen.[24][25] Gnotobiose verwijst naar een gemanipuleerde toestand van een organisme waarin alle levensvormen (d.w.z. micro-organismen) in of op het organisme, inclusief de microbiota, zijn geïdentificeerd. Interessant is dat bij deze kiemvrije muizen de algemene overvloed aan chromogranine A-positieve enteroendocriene cellen afnam in de kronkeldarm en toenam in de dikke darm, wat duidt op een mogelijk verband tussen de microflora en de normale verdeling van sensorische cellen in de darm.[26] Bovendien bezitten humane- en muizen-enteroendocriene cellen receptoren voor microbe-geassocieerde moleculaire patronen (MAMPS) zoals bacteriële lipopolysaccharide (LPS) en receptoren voor een reeks bacteriële metabolieten zoals korteketenvetzuren (SCFAs).[27][28] De aanwezigheid van deze receptoren suggereert dat de synaptisch verbonden L-cellen verantwoordelijk kunnen zijn voor het detecteren van microbiële signalen en metabolieten in het darmlumen en het vervolgens doorgeven van deze informatie aan de hersenen. Ten slotte zijn specifieke pathogene bacteriën (bijvoorbeeld Chlamydia trachomatis) betrokken bij de pathogenese van het prikkelbare darmsyndroom doordat ze enteroendocriene cellen direct infecteren en bepaalde neurotransmittertransporters zoals glutaminezuur upreguleren.[29][30] Ook kunnen worminfecties met Trichinella spiralis leiden tot een aanzienlijke vermindering van de voedselconsumptie, die afhankelijk is van de aanwezigheid en overvloed van enteroendocriene cellen.[31] Deze bevindingen suggereren dat pathogene bacteriën niet alleen toegang kunnen krijgen tot L-cellen en mogelijk het bijbehorende centraal zenuwstelsel, maar dat ze mogelijk ook het gedrag van de gastheer kunnen sturen.
Vernieuwing van L-cellen
L-cellen vernieuwen en differentiëren zich actief gedurende hun hele leven vanuit de stamcellen in de crypten van Lieberkühn. Wanneer volwassen cellen naar de toppen van de darmvlokken migreren, ondergaan ze apoptose en worden ze in het lumen uitgestoten.[11]
Het totale aantal en de omzet van L-cellen, die de peptiden GLP-1, PYY en OXM produceren, zijn hetzelfde bij gezonde patiënten en bij patiënten met diabetes.[32]
Chirurgie van het maag-darmstelsel
Een Roux-en-Y bariatrische chirurgische ingreep resulteert in een verdubbeling van het absolute aantal L-cellen, zonder dat de dichtheid ervan wordt beïnvloed. Deze is genetisch gecodeerd in de totale omzet van het slijmvlies van de dunne darm. De toename van het aantal L-cellen met een factor van ongeveer 2,5 (van ongeveer 7,9 miljoen naar ongeveer 17,5 miljoen) laat zien hoe de darm reageert op operaties die de anatomie van de maag en de voedselstroom veranderen.[33][34] Bij een Roux-en-Y gastric bypass wordt de maag kleiner gemaakt en het spijsverteringskanaal gedeeltelijk omgeleid (bypass).
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Célula L op de Spaanstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Neuropod cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Drucker DJ, Nauck MA (November 2006). The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 368 (9548): 1696–705. PMID 17098089. DOI: 10.1016/s0140-6736(06)69705-5. Gearchiveerd van origineel op 31 december 2014. Geraadpleegd op 31 december 2014.
- ↑ a b c d Liddle R.A. (2019). «Neuropods». Cell Mol Gastroenterol Hepatol (Revisie) 7 (4): 739-747. Geraadpleegd op 18 de november 2019.
- ↑ a b c Pearse A.G.E., Coulling I., Weavers B., Friesen S. (1970). «The endocrine polypeptide cells of the human stomach, duodenum, and jejunum». Gut. 11 (8 ): 649-658. Geraadpleegd op 5 decmber 2019.
- ↑ C. Hidalgo P., M. Vásquez C., B. Lira M., J. Rodríguez G. (2015). «Identificación de Células enteroendocrinas productoras de péptido similar al glucagón tipo 1 (GLP-1) en el intestino de la Alpaca». Rev. investig. vet. Perú (Lima, Perú: SciELO) 26 (3): 373-380. Geraadpleegd op 8 december 2019.
- ↑ Larraza O. (1989). «Células Endócrinas del Estómago Humano Normal». Patología Revista Latinoamericana (pdf) 27 (2): 99.
- ↑ a b Bohórquez D.V., Chandra R., Samsa L.A., Vigna S.R., Liddle R.A. (2011). «Characterization of basal pseudopod-like processes in ileal and colonic PYY cells». J Mol Histol. 42 (1): 3-13.Geraadpleegd op 12 november 2019.
- ↑ a b Hiramatsu K. (2019). «Chicken Intestinal L Cells and Glucagon-like Peptide-1 Secretion». The Journal of Poultry Science J-STAGE (Revisión). doi:10.2141/jpsa.0190003.
- ↑ a b Bohórquez DV, Samsa LA, Roholt A, Medicetty S, Chandra R, Liddle RA (2014). «An Enteroendocrine Cell–Enteric Glia Connection Revealed by 3D Electron Microscopy ». PLoS ONE 9 (2): e89881. doi:10.1371/journal.pone.0089881. Geraadpleegd op 12 november 2019.
- ↑ El-Salhy M., Mazzawi T., Hausken T., Hatlebakk J.G. (2016 ). «Interaction between diet and gastrointestinal endocrine cells». Biomed Rep. (Revisión) 4 (6): 651-656. doi:10.3892/br.2016.649. Geraadpleegd op 15 november 2019.
- ↑ May C.L., Kaestner K.H. (2010). «Gut Endocrine Cell Development». Mol Cell Endocrinol. (Revisión) 323 (1): 70-75. doi:10.1016/j.mce.2009.12.009. Geraadpleegd op 15 november 2019.
- ↑ a b Schonhoff S.E., Giel-Moloney M., Leiter A.B. (2004). «Development and Differentiation of Gut Endocrine Cells». Endocrinology (Revisión) 145 (6): 2639-2644. Geraadpleegd op 15 november 2019.
- ↑ Bertrand, Paul (2009). The cornucopia of intestinal chemosensory transduction. Frontiers in Neuroscience 3. ISSN: 1662-453X. PMID 20582275. PMC 3112321. DOI: 10.3389/neuro.21.003.2009.
- ↑ Cummings, David E., Overduin, Joost (2 januari 2007). Gastrointestinal regulation of food intake. Journal of Clinical Investigation 117 (1): 13–23. ISSN: 0021-9738. PMID 17200702. PMC 1716217. DOI: 10.1172/jci30227.
- ↑ a b Bohórquez, Diego V., Shahid, Rafiq A., Erdmann, Alan, Kreger, Alex M., Wang, Yu (2 januari 2015). Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. Journal of Clinical Investigation 125 (2): 782–786. ISSN: 0021-9738. PMID 25555217. PMC 4319442. DOI: 10.1172/jci78361.
- ↑ a b c Kaelberer, Melanie Maya, Rupprecht, Laura E., Liu, Winston W., Weng, Peter, Bohórquez, Diego V. (8 juli 2020). Neuropod Cells: The Emerging Biology of Gut-Brain Sensory Transduction. Annual Review of Neuroscience 43 (1): 337–353. ISSN: 0147-006X. PMID 32101483. PMC 7573801. DOI: 10.1146/annurev-neuro-091619-022657.
- ↑ Bellono, Nicholas W., Bayrer, James R., Leitch, Duncan B., Castro, Joel, Zhang, Chuchu (June 2017). Enterochromaffin Cells Are Gut Chemosensors that Couple to Sensory Neural Pathways. Cell 170 (1): 185–198.e16. ISSN: 0092-8674. PMID 28648659. PMC 5839326. DOI: 10.1016/j.cell.2017.05.034.
- ↑ a b Psichas, Arianna, Reimann, Frank, Gribble, Fiona M. (9 februari 2015). Gut chemosensing mechanisms. Journal of Clinical Investigation 125 (3): 908–917. ISSN: 0021-9738. PMID 25664852. PMC 4362249. DOI: 10.1172/jci76309.
- ↑ a b c Buchanan, Kelly L., Rupprecht, Laura E., Kaelberer, M. Maya, Sahasrabudhe, Atharva, Klein, Marguerita E. (February 2022). The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience 25 (2): 191–200. ISSN: 1546-1726. PMID 35027761. PMC 8825280. DOI: 10.1038/s41593-021-00982-7.
- ↑ Damak, Sami, Rong, Minqing, Yasumatsu, Keiko, Kokrashvili, Zaza, Varadarajan, Vijaya (8 augustus 2003). Detection of sweet and umami taste in the absence of taste receptor T1r3. Science 301 (5634): 850–853. ISSN: 1095-9203. PMID 12869700. DOI: 10.1126/science.1087155.
- ↑ de Araujo, Ivan E., Oliveira-Maia, Albino J., Sotnikova, Tatyana D., Gainetdinov, Raul R., Caron, Marc G. (27 maart 2008). Food reward in the absence of taste receptor signaling. Neuron 57 (6): 930–941. ISSN: 1097-4199. PMID 18367093. DOI: 10.1016/j.neuron.2008.01.032.
- ↑ Ren, X., Ferreira, J. G., Zhou, L., Shammah-Lagnado, S. J., Yeckel, C. W. (9 juni 2010). Nutrient Selection in the Absence of Taste Receptor Signaling. Journal of Neuroscience 30 (23): 8012–8023. ISSN: 0270-6474. PMID 20534849. PMC 6632684. DOI: 10.1523/jneurosci.5749-09.2010.
- ↑ a b Rogers G.J., Tolhurst G., Ramzan A., Habib A.M., Parker H.E., Gribble F.M., Reimann F. (2011). «Electrical activity‐triggered glucagon‐like peptide‐1 secretion from primary murine L‐cells». The Journal of Physiology 589 (5). Geraadpleegd op 5 december 2019.
- ↑ [https://pmc.ncbi.nlm.nih.gov/articles/PMC2697331/#__ffn_sectitle Frank Reimann, Abdella M. Habib, Gwen Tolhurst, Helen E. Parker, Gareth J. Rogers, and Fiona M. Gribble (2008). «Glucose Sensing in L Cells: A Primary Cell Study». Cell Metab. 8 (6-3): 532-539. doi:10.1016/j.cmet.2008.11.002. Geraadpleegd op 28 november htige peptide 1 (GLP-1) (Enteroglucagon)
- ↑ Dinan, Timothy G., Cryan, John F. (4 december 2016). Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration. The Journal of Physiology 595 (2): 489–503. ISSN: 0022-3751. PMID 27641441. PMC 5233671. DOI: 10.1113/jp273106.
- ↑ Wiertsema, Selma P., van Bergenhenegouwen, Jeroen, Garssen, Johan, Knippels, Leon M. J. (9 maart 2021). The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients 13 (3): 886. ISSN: 2072-6643. PMID 33803407. PMC 8001875. DOI: 10.3390/nu13030886.
- ↑ Duca, Frank A., Swartz, Timothy D., Sakar, Yassine, Covasa, Mihai (2012). Increased oral detection, but decreased intestinal signaling for fats in mice lacking gut microbiota. PLOS ONE 7 (6): e39748. ISSN: 1932-6203. PMID 22768116. PMC 3387243. DOI: 10.1371/journal.pone.0039748.
- ↑ Bogunovic, Milena, Davé, Shaival H., Tilstra, Jeremy S., Chang, Diane T. W., Harpaz, Noam (June 2007). Enteroendocrine cells express functional Toll-like receptors. American Journal of Physiology. Gastrointestinal and Liver Physiology 292 (6): G1770–G1783. ISSN: 0193-1857. PMID 17395901. PMC 3203538. DOI: 10.1152/ajpgi.00249.2006.
- ↑ Kaji, Izumi, Karaki, Shin-Ichiro, Tanaka, Ryo, Kuwahara, Atsukazu (February 2011). Density distribution of free fatty acid receptor 2 (FFA2)-expressing and GLP-1-producing enteroendocrine L cells in human and rat lower intestine, and increased cell numbers after ingestion of fructo-oligosaccharide. Journal of Molecular Histology 42 (1): 27–38. ISSN: 1567-2387. PMID 21113792. DOI: 10.1007/s10735-010-9304-4.
- ↑ Dlugosz, A., Zakikhany, K., Muschiol, S., Hultenby, K., Lindberg, G. (21 augustus 2011). Infection of human enteroendocrine cells with Chlamydia trachomatis: a possible model for pathogenesis in irritable bowel syndrome. Neurogastroenterology & Motility 23 (10): 928–934. ISSN: 1350-1925. PMID 21883697. DOI: 10.1111/j.1365-2982.2011.01765.x.
- ↑ Dlugosz, Aldona, Muschiol, Sandra, Zakikhany, Katherina, Assadi, Ghazaleh, D’Amato, Mauro (2014). Human enteroendocrine cell responses to infection with Chlamydia trachomatis: a microarray study. Gut Pathogens 6 (1): 24. ISSN: 1757-4749. PMID 24959205. PMC 4067063. DOI: 10.1186/1757-4749-6-24.
- ↑ Worthington, John J., Klementowicz, Joanna E., Rahman, Sayema, Czajkowska, Beata I., Smedley, Catherine (3 oktober 2013). Loss of the TGFβ-Activating Integrin αvβ8 on Dendritic Cells Protects Mice from Chronic Intestinal Parasitic Infection via Control of Type 2 Immunity. PLOS Pathogens 9 (10): e1003675. ISSN: 1553-7374. PMID 24098124. PMC 3789784. DOI: 10.1371/journal.ppat.1003675.
- ↑ Kunz-Martínez W., Pérez-Pacheco A.I. (2018). «Bipartición de tránsito intestinal, la nueva era de la cirugía metabólica para la diabetes mellitus de tipo 2.». Rev Colomb Cir. (Artículo de revisión) (SciELO) 33: 406-420. Geraadpleegd op 15 november 2019.
- ↑ Hansen CF, Bueter M, Theis N, Lutz T, Paulsen S, Dalbøge LS, (2013). «Hypertrophy Dependent Doubling of L-Cells in Roux-en-Y Gastric Bypass Operated Rats». PLOS ONE 8 (6): e65696. doi:10.1371/journal.pone.0065696.
- ↑ M.S. Svane, N. B. Jørgensen, K.N. Bojsen-Møller, C. Dirksen, S. Nielsen, V.B. Kristiansen, S. Toräng, N.J. Wewer Albrechtsen, J.F. Rehfeld, B. Hartmann, S. Madsbad, J.J. Holst (2016). «Peptide YY and glucagon-like peptide-1 contribute to decreased food intake after Roux-en-Y gastric bypass surgery». International Journal of Obesity 40: 1699-1706. Geraadpleegd op 6 december 2019.