Notch (eiwit)
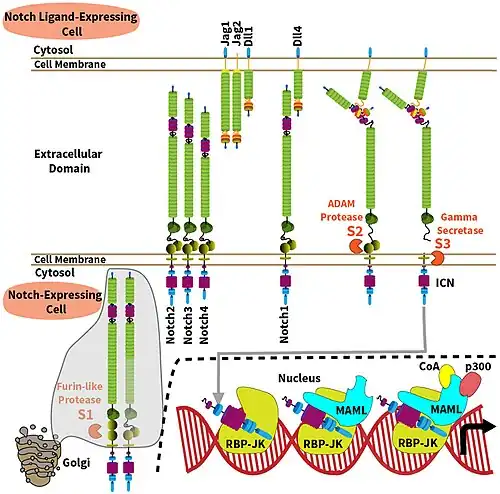
Notch-eiwitten zijn een familie van type 1 transmembraaneiwitten die een kerncomponent vormen van de Notch-signalering, dat sterk geconserveerd is bij dieren. Het Notch extracellulaire domein bemiddelt interacties met DSL-familieliganden (DSL: Delta/Serrate/Lag-2, Delta=DLL1/DLL3/DLL4, Serrate=JAG1/JAG2), waardoor het kan deelnemen aan juxtacriene signalering. Juxtacriene communicatie is een vorm van celsignalering tussen aangrenzende cellen waarbij oligosachariden, lipiden of membraaneiwitten betrokken zijn en die van invloed is op de zendende cel of op enkele aangrenzende cellen.
Het Notch intracellulaire domein fungeert als een transcriptionele activator wanneer het een complex vormt met CSL-familietranscriptiefactoren (CSL: Suppressor of Hairless, Lag-1). Leden van deze type 1 transmembraaneiwitfamilie delen verschillende kernstructuren, waaronder een extracellulair domein dat bestaat uit meerdere epidermale groeifactor (EGF)-achtige herhalingen en een intracellulair transcriptioneel activeringsdomein (TAD: Topologically associating domain). Notch-familieleden opereren in verschillende weefsels en spelen een rol in verschillende ontwikkelingsprocessen door beslissingen tijdens de celdifferentiatie het lot van een cel te controleren. Veel van wat bekend is over de Notch-functie komt uit studies die zijn uitgevoerd in Caenorhabditis elegans en Drosophila melanogaster. Menselijke homologen zijn ook geïdentificeerd, maar details van de Notch-functie en interacties met zijn liganden zijn in deze context niet goed bekend.
Structuur
_and_corepressor_complexes_(lower).png)
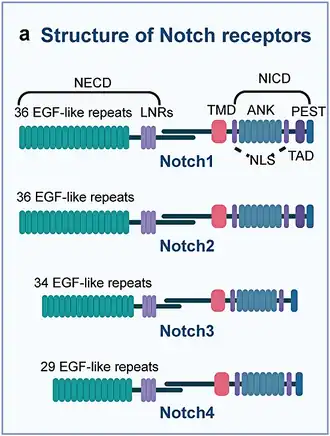
Drosophila melanogaster bevat één Notch-eiwit, Caenorhabditis elegans bevat twee redundante Notch-paralogen, Lin-12[1] en GLP-1,[2][3] en mensen hebben vier Notch-varianten, Notch 1-4. Hoewel er variaties bestaan tussen homologen, is er een set van zeer geconserveerde structuren gevonden in alle Notch-familie-eiwitten. Het eiwit kan grofweg worden gesplitst in het Notch extracellulaire domein (NECD) en Notch intracellulaire domein (NICD) die met elkaar verbonden zijn door een single-pass transmembraandomein (TM). Een single-pass membraaneiwit is een transmembraaneiwit dat de lipide-dubbellaag slechts één keer overspant.
Het NECD bevat 36 EGF-herhalingen in Drosophila melanogaster,[4] 28-36 bij mensen, en 13 en 10 in Caenorhabditis elegans Lin-12 en GLP-1 respectievelijk.[5] Deze herhalingen worden sterk gemodificeerd door O-glycosylering[6] en de toevoeging van specifieke O-gekoppelde glycanen is noodzakelijk gebleken voor een goede werking. De EGF-herhalingen worden gevolgd door drie cysteïnerijke Lin-12/Notch-herhalingen (LNR) en een heterodimerisatiedomein (HD). Samen vormen de LNR en HD het negatieve regulerende regio grenzend aan het celmembraan en helpen signalering te voorkomen bij afwezigheid van ligandbinding.
NICD fungeert als een transcriptiefactor die wordt vrijgegeven nadat ligandbinding de splitsing ervan te weeg brengt. Het bevat een celkern lokalisatiesequentie (NLS) die de translocatie naar de celkern bemiddelt, waar het een transcriptioneel complex vormt samen met verschillende andere transcriptiefactoren. Eenmaal in de celkern, interageren verschillende ankyrine-repeats en het RAM-domein (RNMT-Activating Mini-protein, RNMT: mRNA (guanine-N7-)-methyltransferase) tussen de NICD- en CSL-eiwitten om een transcriptioneel activeringscomplex te vormen.[7] Bij mensen speelt een extra PEST-domein een rol bij de afbraak van NICD.[30] PEST is een primaire eiwitstructuur dat veel proline (P), glutaminezuur (E), serine (S) en threonine (T) bevat.
Functie
Notch-familieleden spelen een rol in verschillende ontwikkelingsprocessen door beslissingen over het lot van een cel bij de celdifferentiatie te controleren. Het Notch-signaleringsnetwerk is een evolutionair geconserveerde intercellulair signalering dat interacties tussen fysiek aangrenzende cellen reguleert. In Drosophila melanogaster vestigt de Notch-interactie met zijn celgebonden liganden een intercellulaire signalering dat een sleutelrol speelt in de ontwikkeling. Dit eiwit functioneert als een receptor voor membraangebonden liganden en kan meerdere rollen spelen tijdens de ontwikkeling.[9]Een tekort kan worden geassocieerd met een bicuspide aortaklep ( aortaklep met niet de gebruikelijke drie klepslippen, maar met slechts twee[10]).[11]
Er is bewijs dat geactiveerde Notch 1 en Notch 3 de differentiatie van voorlopercellen bevorderen.[12] Notch 1, dat dan al vóór de geboorte wordt geactiveerd, induceert radiale gliacel-differentiatie,[13] maar induceert na de geboorte de differentiatie in astrocyten.[14] Uit één onderzoek blijkt dat de Notch 1-cascade op een onbekende manier wordt geactiveerd door Reeline.[15] Volgens een ander onderzoek werken Reeline en Notch 1 samen bij de ontwikkeling van de gyrus dentatus.[16]
Ligandinteracties
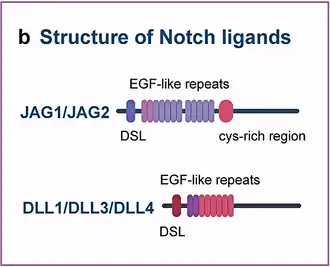
Notch-signalering wordt geactiveerd via direct cel-tot-celcontact, gemedieerd door interacties tussen het Notch-receptoreiwit in de signaalontvangende cel en een ligand in een aangrenzende signaaldoorgevende cel. Deze type 1 single-pass transmembraaneiwitten vallen in de Delta/Serrate/Lag-2 (DSL)-familie van eiwitten, die is vernoemd naar de drie canonieke Notch-liganden.[17] Delta en Serrate worden aangetroffen in Drosophila melanogaster, terwijl Lag-2 wordt aangetroffen in Caenorhabditis elegans. Mensen bevatten 3 Delta-homologen, Delta-achtige 1, 3 en 4, evenals twee Serrate-homologen, Jagged 1 en 2. Notch-eiwitten bestaan uit een relatief kort intracellulair domein en een groot extracellulair domein met een of meer EGF-motieven en een N-terminus DSL-bindend motief. EGF-herhalingen 11-12 op het extracellulaire Notch-domein zijn noodzakelijk en voldoende gebleken voor trans-signaleringsinteracties tussen Notch en zijn liganden.[18] Bovendien zijn EGF-herhalingen 24-29 betrokken bij de remming van cis-interacties tussen Notch en liganden die in dezelfde cel worden samen tot expressie gebracht.[19]
Proteolyse
Om een signaalgebeurtenis te laten plaatsvinden, moet het Notch-eiwit op verschillende plaatsen worden gesplitst. Bij mensen wordt Notch eerst gesplitst in het NRR-domein door furine terwijl het wordt verwerkt in het trans-Golgi-netwerk voordat het op het celoppervlak wordt gepresenteerd als een heterodimeer.[20][21] Drosophila melanogaster-Notch heeft deze splitsing niet nodig om signaaloverdracht te laten plaatsvinden,[22] en er is enig bewijs dat suggereert dat LIN-12 en GLP-1 op deze plaats worden gesplitst in Caenorhabditis elegans.
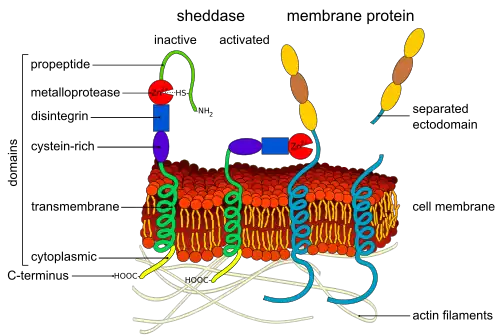
Vrijgave van de NICD wordt bereikt na nog eens twee splitsingsgebeurtenissen aan Notch. Binding van Notch aan een DSL-ligand resulteert in een conformationele verandering die een splitsingsplaats in de NECD blootlegt. Enzymatische proteolyse op deze plaats wordt uitgevoerd door een A Disintegrin and Metalloprotease-domein (ADAM)-familieprotease. Dit eiwit wordt Kuzbanian genoemd in Drosophila melanogaster,[23][24] sup-17 in Caenorhabditis elegans,[25] en ADAM10 bij mensen.[26][27] Na proteolytische splitsing ondergaat de vrijgekomen NECD endocytose in de signaaloverdragende cel, waarbij slechts een klein extracellulair deel van Notch achterblijft. Dit afgeknotte Notch-eiwit kan vervolgens worden herkend door een γ-secretase die de derde plaats in het TM-domein (single-pass transmembraandomein) splitst.[28]
Ontdekking

Notch werd ontdekt in een gemuteerde Drosophila melanogaster in maart 1913 in het laboratorium van Thomas Hunt Morgan.[29] Deze mutant ontstond na verschillende generaties van het kruisen en terugkruisen van gleufvleugelvliegen met wilde-type vliegen en werd voor het eerst gekarakteriseerd door John S. Dexter.[30] Het meest frequent waargenomen fenotype in Notch-mutante vliegen is het verschijnen van een ronde inkeping (engels:notch) aan het meest distale uiteinde van de vleugels, waarnaar het gen is vernoemd, vergezeld door een zijkant zonder borstelharen.[31][32]Het bleek een dominant geslachtsgebonden mutant op het X-chromosoom te zijn die alleen kon worden waargenomen bij heterozygote vrouwtjes, omdat het dodelijk was bij mannetjes en homozygote vrouwtjes.[29] Het eerste Notch-allel werd in 1917 vastgesteld door C.W. Metz en C.B. Bridges.[33] Eind jaren dertig leverden studies van vliegenembryogenese, uitgevoerd door Donald F. Poulson, de eerste indicatie van Notch's rol in de embryonale ontwikkeling.[34] Notch-8 mutante mannetjes vertoonden een gebrek aan de binnenste kiembladen, het endoderm en mesoderm, wat resulteerde in embryonale letaliteit. Latere studies in vroege Drosophila melanogaster-neurogenese leverden enkele van de eerste indicaties van Notch's rol in cel-cel signalering, aangezien het zenuwstelsel in Notch mutanten werd ontwikkeld door het opofferen van hypodermale cellen.[35]
Vanaf de jaren tachtig begonnen onderzoekers meer inzicht te krijgen in de functie van Notch door middel van genetische en moleculaire experimenten. Genetische screenings uitgevoerd in Drosophila melanogaster leidden tot de identificatie van verschillende eiwitten die een centrale rol spelen bij de Notch-signalering, waaronder enhancer of split (E(spl),[35] Master mind, Delta,[36] Suppressor of Hairless (CSL),[37] en Serrate.[38] Tegelijkertijd werd het Notch-gen succesvol gesequenced[39][4] en gekloond,[40][41] wat inzicht gaf in de moleculaire architectuur van Notch-eiwitten en leidde tot de identificatie van Notch-homologen in Caenorhabditis elegans[42][43][2] en uiteindelijk in zoogdieren.
Begin jaren negentig werd Notch steeds meer geïmpliceerd als de receptor van een voorheen onbekende intercellulair celsignalering[17][44] waarin het intercellulaire domein van Notch (NICD) naar de celkern wordt getransporteerd waar het fungeert als een transcriptiefactor om doelgenen rechtstreeks te reguleren.[45][46][47] De vrijgave van de NICD bleek het resultaat te zijn van proteolytische splitsing van het transmembraaneiwit door de acties van de katalytische subeenheid preseniline van het γ-secretasecomplex. Dit was een belangrijke interactie, aangezien preseniline betrokken is bij de ontwikkeling van de ziekte van Alzheimer.[48] Dit en verder onderzoek naar het mechanisme van Notch-signalering leidden tot onderzoek dat Notch verder in verband zou brengen met een breed scala aan menselijke ziekten.
Klinische betekenis
De oorzaak van het syndroom van Alagille is nog niet volledig opgehelderd. Bij ca 70% van de patiënten zijn afwijkingen in een gen genaamd JAG1 aantoonbaar. Het gen ligt op chromosoom 20, locatie 20p12. Het codeert voor Jagged 1, dat een functie heeft bij signaaluitwisseling tussen cellen zowel tijdens de embryonale ontwikkeling als daarna.
Mutaties in het Notch2-gen veroorzaakt het Hajdu–Cheney syndroom. Het is een uiterst zeldzame autosomaal dominante aangeboren afwijking[49][50] van het bindweefsel, gekenmerkt door ernstige en overmatige botresorptie die leidt tot osteoporose en een breed scala aan andere mogelijke symptomen.
Mutaties in Notch3 zijn geïdentificeerd als de onderliggende oorzaak van het CADASIL-syndroom (cerebrale autosomale dominant arteriopathie met subcorticale infarcten en leukencefalopathie).[51] Mutaties in Notch3 zijn ook geïdentificeerd in families met de ziekte van Alzheimer.[52] Volwassen Notch3-knock-outmuizen vertonen onvolledige neuronale rijping in de dorsale hoorn van het ruggenmerg, wat resulteert in permanent verhoogde nociceptieve pijngevoeligheid.[53] Mutaties in Notch3 zijn geassocieerd met het laterale meningocele-syndroom.[54][55]
Mutaties in het Notch4-gen kunnen in een klein deel van de gevallen worden geassocieerd met vatbaarheid voor schizofrenie.[56]
- voetnoten
- ↑ Greenwald IS, Sternberg PW, Horvitz HR (September 1983). The lin-12 locus specifies cell fates in Caenorhabditis elegans. Cell 34 (2): 435–44. PMID 6616618. DOI: 10.1016/0092-8674(83)90377-x.
- ↑ a b Austin J, Kimble J (November 1987). glp-1 is required in the germ line for regulation of the decision between mitosis and meiosis in C. elegans. Cell 51 (4): 589–99. PMID 3677168. DOI: 10.1016/0092-8674(87)90128-0.
- ↑ Austin J, Kimble J (August 1989). Transcript analysis of glp-1 and lin-12, homologous genes required for cell interactions during development of C. elegans. Cell 58 (3): 565–71. PMID 2758467. DOI: 10.1016/0092-8674(89)90437-6.
- ↑ a b Wharton KA, Johansen KM, Xu T, Artavanis-Tsakonas S (December 1985). Nucleotide sequence from the neurogenic locus notch implies a gene product that shares homology with proteins containing EGF-like repeats. Cell 43 (3 Pt 2): 567–81. PMID 3935325. DOI: 10.1016/0092-8674(85)90229-6.
- ↑ Greenwald I (December 1985). lin-12, a nematode homeotic gene, is homologous to a set of mammalian proteins that includes epidermal growth factor. Cell 43 (3 Pt 2): 583–90. PMID 3000611. DOI: 10.1016/0092-8674(85)90230-2.
- ↑ Shao L, Luo Y, Moloney DJ, Haltiwanger R (November 2002). O-glycosylation of EGF repeats: identification and initial characterization of a UDP-glucose: protein O-glucosyltransferase. Glycobiology 12 (11): 763–70. PMID 12460944. DOI: 10.1093/glycob/cwf085.
- ↑ Tamura K, Taniguchi Y, Minoguchi S, Sakai T, Tun T, Furukawa T, Honjo T (December 1995). Physical interaction between a novel domain of the receptor Notch and the transcription factor RBP-J kappa/Su(H). Current Biology 5 (12): 1416–23. PMID 8749394. DOI: 10.1016/S0960-9822(95)00279-X.
- ↑ (en) Shi, Qingmiao, Xue, Chen, Zeng, Yifan, Yuan, Xin, Chu, Qingfei (27 mei 2024). Notch signaling pathway in cancer: from mechanistic insights to targeted therapies. Signal Transduction and Targeted Therapy 9 (1): 1–37. ISSN:2059-3635. DOI:10.1038/s41392-024-01828-x.
- ↑ Entrez Gene: NOTCH1 Notch homolog 1, translocation-associated (Drosophila).
- ↑ De bicuspide aortaklep; een van de meest voorkomende aangeboren hartafwijkingen
- ↑ McKellar SH, Tester DJ, Yagubyan M, Majumdar R, Ackerman MJ, Sundt TM (August 2007). Novel NOTCH1 mutations in patients with bicuspid aortic valve disease and thoracic aortic aneurysms. The Journal of Thoracic and Cardiovascular Surgery 134 (2): 290–6. PMID 17662764. DOI: 10.1016/j.jtcvs.2007.02.041.
- ↑ Tanigaki K, Nogaki F, Takahashi J, Tashiro K, Kurooka H, Honjo T (January 2001). Notch1 and Notch3 instructively restrict bFGF-responsive multipotent neural progenitor cells to an astroglial fate. Neuron 29 (1): 45–55. PMID 11182080. DOI: 10.1016/S0896-6273(01)00179-9.
- ↑ Gaiano N, Nye JS, Fishell G (May 2000). Radial glial identity is promoted by Notch1 signaling in the murine forebrain. Neuron 26 (2): 395–404. PMID 10839358. DOI: 10.1016/S0896-6273(00)81172-1.
- ↑ Chambers CB, Peng Y, Nguyen H, Gaiano N, Fishell G, Nye JS (March 2001). Spatiotemporal selectivity of response to Notch1 signals in mammalian forebrain precursors. Development 128 (5): 689–702. PMID 11171394. DOI: 10.1242/dev.128.5.689.
- ↑ Keilani S, Sugaya K (July 2008). Reelin induces a radial glial phenotype in human neural progenitor cells by activation of Notch-1. BMC Developmental Biology 8 (1): 69. PMID 18593473. PMC 2447831. DOI: 10.1186/1471-213X-8-69.
- ↑ Sibbe M, Förster E, Basak O, Taylor V, Frotscher M (July 2009). Reelin and Notch1 cooperate in the development of the dentate gyrus. The Journal of Neuroscience 29 (26): 8578–85. PMID 19571148. PMC 6665659. DOI: 10.1523/JNEUROSCI.0958-09.2009.
- ↑ a b Artavanis-Tsakonas S, Matsuno K, Fortini ME (April 1995). Notch signaling. Science 268 (5208): 225–32. PMID 7716513. DOI: 10.1126/science.7716513.
- ↑ Rebay I, Fleming RJ, Fehon RG, Cherbas L, Cherbas P, Artavanis-Tsakonas S (November 1991). Specific EGF repeats of Notch mediate interactions with Delta and Serrate: implications for Notch as a multifunctional receptor. Cell 67 (4): 687–99. PMID 1657403. DOI: 10.1016/0092-8674(91)90064-6.
- ↑ de Celis JF, Bray SJ (March 2000). The Abruptex domain of Notch regulates negative interactions between Notch, its ligands and Fringe. Development 127 (6): 1291–302. PMID 10683181. DOI: 10.1242/dev.127.6.1291.
- ↑ Blaumueller CM, Qi H, Zagouras P, Artavanis-Tsakonas S (July 1997). Intracellular cleavage of Notch leads to a heterodimeric receptor on the plasma membrane. Cell 90 (2): 281–91. PMID 9244302. DOI: 10.1016/s0092-8674(00)80336-0.
- ↑ Logeat F, Bessia C, Brou C, LeBail O, Jarriault S, Seidah NG, Israël A (July 1998). The Notch1 receptor is cleaved constitutively by a furin-like convertase. Proceedings of the National Academy of Sciences of the United States of America 95 (14): 8108–12. PMID 9653148. PMC 20937. DOI: 10.1073/pnas.95.14.8108.
- ↑ Kidd S, Lieber T (July 2002). Furin cleavage is not a requirement for Drosophila Notch function. Mechanisms of Development 115 (1–2): 41–51. PMID 12049766. DOI: 10.1016/s0925-4773(02)00120-x.
- ↑ Rooke J, Pan D, Xu T, Rubin GM (August 1996). KUZ, a conserved metalloprotease-disintegrin protein with two roles in Drosophila neurogenesis. Science 273 (5279): 1227–31. PMID 8703057. DOI: 10.1126/science.273.5279.1227.
- ↑ Pan D, Rubin GM (July 1997). Kuzbanian controls proteolytic processing of Notch and mediates lateral inhibition during Drosophila and vertebrate neurogenesis. Cell 90 (2): 271–80. PMID 9244301. DOI: 10.1016/s0092-8674(00)80335-9.
- ↑ Wen C, Metzstein MM, Greenwald I (December 1997). SUP-17, a Caenorhabditis elegans ADAM protein related to Drosophila KUZBANIAN, and its role in LIN-12/NOTCH signalling. Development 124 (23): 4759–67. PMID 9428412. DOI: 10.1242/dev.124.23.4759.
- ↑ Howard L, Glynn P (1995). Proteolytic Enzymes: Aspartic and Metallo Peptidases. DOI:10.1016/0076-6879(95)48025-0, "Membrane-associated metalloproteinase recognized by characteristic cleavage of myelin basic protein: Assay and isolation", 388–95. ISBN 9780121821494.
- ↑ Lunn CA, Fan X, Dalie B, Miller K, Zavodny PJ, Narula SK, Lundell D (January 1997). Purification of ADAM 10 from bovine spleen as a TNFalpha convertase. FEBS Letters 400 (3): 333–5. PMID 9009225. DOI: 10.1016/s0014-5793(96)01410-x.
- ↑ Struhl G, Adachi A (September 2000). Requirements for presenilin-dependent cleavage of notch and other transmembrane proteins. Molecular Cell 6 (3): 625–36. PMID 11030342. DOI: 10.1016/s1097-2765(00)00061-7.
- ↑ a b Morgan, Thomas Hunt, Bridges, Calvin B. (1916). Sex-linked inheritance in Drosophila, NCSU Libraries. Washington, Carnegie Institution of Washington.
- ↑ Dexter, John S. (December 1914). The Analysis of a Case of Continuous Variation in Drosophila by a Study of Its Linkage Relations. The American Naturalist 48 (576): 712–758. DOI: 10.1086/279446.
- ↑ Mohr OL (May 1919). Character Changes Caused by Mutation of an Entire Region of a Chromosome in Drosophila. Genetics 4 (3): 275–82. PMID 17245926. PMC 1200460. DOI: 10.1093/genetics/4.3.275.
- ↑ Lindsley, Dan L., Zimm, Georgianna G. (2 december 2012). The Genome of Drosophila Melanogaster. Academic Press. ISBN 9780323139847.
- ↑ Metz CW, Bridges CB (December 1917). Incompatibility of Mutant Races in Drosophila. Proceedings of the National Academy of Sciences of the United States of America 3 (12): 673–8. PMID 16586764. PMC 1091355. DOI: 10.1073/pnas.3.12.673.
- ↑ Poulson DF (March 1937). Chromosomal Deficiencies and the Embryonic Development of Drosophila Melanogaster. Proceedings of the National Academy of Sciences of the United States of America 23 (3): 133–7. PMID 16588136. PMC 1076884. DOI: 10.1073/pnas.23.3.133.
- ↑ a b Lehmann R, Jiménez F, Dietrich U, Campos-Ortega JA (March 1983). On the phenotype and development of mutants of early neurogenesis inDrosophila melanogaster. Wilhelm Roux's Archives of Developmental Biology 192 (2): 62–74. PMID 28305500. DOI: 10.1007/BF00848482.
- ↑ Lehmann R, Dietrich U, Jiménez F, Campos-Ortega JA (July 1981). Mutations of early neurogenesis inDrosophila. Wilhelm Roux's Archives of Developmental Biology 190 (4): 226–229. PMID 28305572. DOI: 10.1007/BF00848307.
- ↑ Fortini ME, Artavanis-Tsakonas S (October 1994). The suppressor of hairless protein participates in notch receptor signaling. Cell 79 (2): 273–82. PMID 7954795. DOI: 10.1016/0092-8674(94)90196-1.
- ↑ Fleming RJ, Scottgale TN, Diederich RJ, Artavanis-Tsakonas S (December 1990). The gene Serrate encodes a putative EGF-like transmembrane protein essential for proper ectodermal development in Drosophila melanogaster. Genes & Development 4 (12A): 2188–201. PMID 2125287. DOI: 10.1101/gad.4.12a.2188.
- ↑ Kidd S, Kelley MR, Young MW (September 1986). Sequence of the notch locus of Drosophila melanogaster: relationship of the encoded protein to mammalian clotting and growth factors. Molecular and Cellular Biology 6 (9): 3094–108. PMID 3097517. PMC 367044. DOI: 10.1128/mcb.6.9.3094.
- ↑ Kidd S, Lockett TJ, Young MW (September 1983). The Notch locus of Drosophila melanogaster. Cell 34 (2): 421–33. PMID 6193889. DOI: 10.1016/0092-8674(83)90376-8.
- ↑ Artavanis-Tsakonas S, Muskavitch MA, Yedvobnick B (April 1983). Molecular cloning of Notch, a locus affecting neurogenesis in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America 80 (7): 1977–81. PMID 6403942. PMC 393735. DOI: 10.1073/pnas.80.7.1977.
- ↑ Greenwald I (February 1987). The lin-12 locus of Caenorhabditis elegans. BioEssays 6 (2): 70–3. PMID 3551950. DOI: 10.1002/bies.950060207.
- ↑ Priess JR, Schnabel H, Schnabel R (November 1987). The glp-1 locus and cellular interactions in early C. elegans embryos. Cell 51 (4): 601–11. PMID 3677169. DOI: 10.1016/0092-8674(87)90129-2.
- ↑ Greenwald I, Rubin GM (January 1992). Making a difference: the role of cell-cell interactions in establishing separate identities for equivalent cells. Cell 68 (2): 271–81. PMID 1365402. DOI: 10.1016/0092-8674(92)90470-w.
- ↑ Schroeter EH, Kisslinger JA, Kopan R (May 1998). Notch-1 signalling requires ligand-induced proteolytic release of intracellular domain. Nature 393 (6683): 382–6. PMID 9620803. DOI: 10.1038/30756.
- ↑ Kopan R, Nye JS, Weintraub H (September 1994). The intracellular domain of mouse Notch: a constitutively activated repressor of myogenesis directed at the basic helix-loop-helix region of MyoD. Development 120 (9): 2385–96. PMID 7956819. DOI: 10.1242/dev.120.9.2385.
- ↑ Struhl G, Fitzgerald K, Greenwald I (July 1993). Intrinsic activity of the Lin-12 and Notch intracellular domains in vivo. Cell 74 (2): 331–45. PMID 8343960. DOI: 10.1016/0092-8674(93)90424-o.
- ↑ (en) Sherrington R, Rogaev EI, Liang Y, Rogaeva EA, Levesque G, Ikeda M, Chi H, Lin C, Li G, Holman K, Tsuda T, Mar L, Foncin JF, Bruni AC, Montesi MP, Sorbi S, Rainero I, Pinessi L, Nee L, Chumakov I, Pollen D, Brookes A, Sanseau P, Polinsky RJ, Wasco W, Da Silva HA, Haines JL, Perkicak-Vance MA, Tanzi RE, Roses AD, Fraser PE, Rommens JM, St George-Hyslop PH (June 1995). Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease. Nature 375 (6534): 754–60. PMID 7596406. DOI: 10.1038/375754a0.
- ↑ Crifasi PA, Patterson MC, Bonde D, Michels VV (June 1997). Severe Hajdu-Cheney syndrome with upper airway obstruction. American Journal of Medical Genetics 70 (3): 261–6. PMID 9188663. DOI: <261::AID-AJMG9>3.0.CO;2-Z 10.1002/(SICI)1096-8628(19970613)70:3<261::AID-AJMG9>3.0.CO;2-Z.
- ↑ Brennan AM, Pauli RM (May 2001). Hajdu--Cheney syndrome: evolution of phenotype and clinical problems. American Journal of Medical Genetics 100 (4): 292–310. PMID 11343321. DOI: <292::AID-AJMG1308>3.0.CO;2-4 10.1002/1096-8628(20010515)100:4<292::AID-AJMG1308>3.0.CO;2-4.
- ↑ Entrez Gene: NOTCH3 Notch homolog 3 (Drosophila).
- ↑ Guerreiro RJ, Lohmann E, Kinsella E, Brás JM, Luu N, Gurunlian N, Dursun B, Bilgic B, Santana I, Hanagasi H, Gurvit H, Gibbs JR, Oliveira C, Emre M, Singleton A (2012). Exome sequencing reveals an unexpected genetic cause of disease: NOTCH3 mutation in a Turkish family with Alzheimer's disease. Neurobiol. Aging 33 (5): 1008.e17–23. PMID 22153900. PMC 3306507. DOI: 10.1016/j.neurobiolaging.2011.10.009.
- ↑ Rusanescu G, Mao J (2014). Notch3 is necessary for neuronal differentiation and maturation in the adult spinal cord. J. Cell. Mol. Med. 18 (10): 2103–16. PMID 25164209. PMC 4244024. DOI: 10.1111/jcmm.12362.
- ↑ Laterale meningocele-syndroom Orphanet
- ↑ Gripp KW, Robbins KM, Sobreira NL, Witmer PD, Bird LM, Avela K, Makitie O, Alves D, Hogue JS, Zackai EH, Doheny KF, Stabley DL, Sol-Church K (2014). Afkappende mutaties in het laatste exon van NOTCH3 veroorzaken lateraal meningocelesyndroom. Am. J. Med. Genet. A 167A: 271–81. PMID 25394726. PMC 5589071. DOI: 10.1002/ajmg.a.36863.
- ↑ Shayevitz C, Cohen OS, Faraone SV, Glatt SJ (July 2012). A re-review of the association between the NOTCH4 locus and schizophrenia. Am. J. Med. Genet. B Neuropsychiatr. Genet. 159B (5): 477–83. PMID 22488909. DOI: 10.1002/ajmg.b.32050.
- bronvermelding
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Notch proteins op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.