Ectodomein
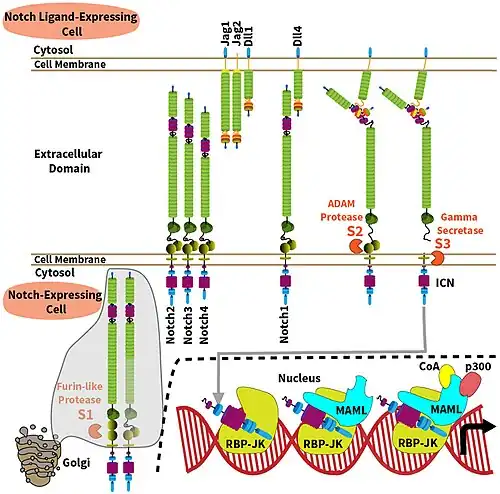
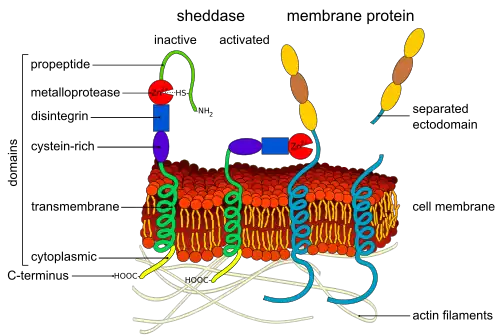
Een ectodomein of extracellulair domein is het domein van een membraaneiwit dat zich uitstrekt tot in de extracellulaire ruimte.
Ectodomeinen zijn meestal de delen van eiwitten die contact maken met celoppervlakken, wat leidt tot signaaltransductie. Een opmerkelijk voorbeeld van een ectodomein is het spike-eiwit, van het virale deeltje dat verantwoordelijk is voor de COVID-19-pandemie. Het ectodomeingebied van het spike-eiwit is essentieel voor hechting aan en uiteindelijke binnendringing van het virale eiwit in de gastheercel.[1]
Ectodomeinen interacteren ook met membraansystemen en induceren vesikelaggregatie, lipidenmenging en liposomale lekkage, wat informatie verschaft over hoe bepaalde virussen infecties door het cellulaire domein verspreiden. Specifiek maakt het hepatitis C-virus (HCV) gebruik van een fusieproces waarbij het ectodomein van het HCV E2-envelopproteïne fusogene eigenschappen verleent aan membraansystemen, wat impliceert dat HCV-infectie door de hele cel verloopt via receptor-gemedieerde endocytose.[2]
Afsplitsing ectodomein
Het afsplitsen van het ectodomein is een eerste stap voor de activering van specifieke receptoren zoals Notch, ERBB4 en de angiopoietine-receptor (Tie-1). Notch-1-signalering is essentieel voor endothele differentiatie en tumorangiogenese, terwijl de angiopoietine-receptor Tie-1 de vorming van embryonale bloedvaten faciliteert.[3][4] Na binding van hun liganden ondergaan Notch-1 en Tie-1 proteolytische splitsing van de ectodomeinen door ADAM17 en ADAM10. Deze splitsing maakt het cytoplasmatische fragment vrij voor celsignalering. In het geval van Notch-1 wordt het overgebracht naar de celkern.
Veel cytokines en groeifactoren worden gesynthetiseerd als membraangebonden proformen die proteolytische afstoting ondergaan voor activering. Groeifactoren zijn groeibepalende proteïnen die door bepaalde cellen worden gemaakt en afgegeven. De ephrines EPH-receptor A2 en A3 worden door ADAM10 afgesplitst, waardoor oplosbare Eph-receptoren ontstaan, die tumorangiogenese bij muizen remmen.[5] Andere voorbeelden zijn de proteolytische afsplitsing van oplosbare E-selectine,[6] de afsplising van de urokinase-receptor (uPAR) door MMP-12 (matrix metalloproteinase-12), waardoor oplosbare uPAR ontstaat die chemotaxische eigenschappen heeft voor leukocyten en voorlopercellen, en de afstoting van IL-6-receptoren door ADAM10 en ADAM17, die de IL-6-signalering in endotheelcellen faciliteert.[7] Semaphorine 4D (CD100) wordt door MT1-MMP (MMP-14) in tumorcellen van zijn membraangebonden vorm afgesplitst; het interageert vervolgens met plexine B1 op endotheelcellen, waardoor pro-angiogene chemotaxis wordt bevorderd.[8] Het afsplitsen van een membraanverankerd cytokine of groeifactor door ADAM-proteïnasen kan relevant zijn voor verschillende signaaltransductiegebeurtenissen. Als alternatief kan het afsplitsen vereist zijn om het ligand te laten diffunderen naar ver voorkomende receptoren. Het afsplisen kan vereist zijn voor de downregulatie van signalen door het verwijderen van signaalliganden, of splitsing en vrijgave van receptoren. Vrijgave van de receptor kan ook oplosbare receptoren genereren die als lokaas fungeren door liganden te sequencen. Deze bevindingen geven aan dat het afstoten van ectodomeinen een alomtegenwoordig proces is dat een breed scala aan cellulaire gebeurtenissen faciliteert die betrokken zijn bij angiogenese. Samen met ADAM's en MT-MMP's kunnen membraangebonden serineproteasen ook een rol spelen bij het afsplitsen van ectodomeinen.
Ziekte van Alzheimer
Het afstoten van ectodomeinen speelt een belangrijke rol bij de ziekte van Alzheimer. De α-secretases, zoals ADAM 9, ADAM 10 en ADAM 17, splitsen bijvoorbeeld het integrale membraaneiwit APP (amyloïde precursor-eiwit) op de ‘juiste’ plaats (dichtbij het celmembraan), terwijl de β-secretase (BACE1) het APP op de ‘verkeerde’ plaats splitst (verder in de extracellulaire ruimte). Vervolgens splitst de γ-secretase het APP-residu in het celmembraan door, ongeacht of de α- of β-secretase het APP eerder heeft gesplitst. Het grotere fragment (38, 40 of 42 aminozuren) dat voortkomt uit de eerste splitsing, bèta-amyloïd (Aβ) genaamd, leidt tot de amyloïde plaques, terwijl het fragment dat voortkomt uit de α-secretase, P3 genaamd, geen plaques vormt.[9][10]
- voetnoten
- ↑ Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, Graham BS, McLellan JS (March 2020). Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367 (6483): 1260–1263. PMID 32075877. PMC 7164637. DOI: 10.1126/science.abb2507.
- ↑ Rodríguez-Rodríguez, Mar, Tello, Daniel, Gómez-Gutiérrez, Julián, L. Peterson, Darrell L, Gavilanes, Francisco (March 2018). Fusogenic properties of the Ectodomain of HCV E2 envelope protein. Biochimica et Biophysica Acta (BBA) - Biomembranes 1860 (3): 728–736. PMID 29273334. DOI: 10.1016/j.bbamem.2017.12.017. Geraadpleegd op 10 May 2022.
- ↑ Gridley, T (2007). Notch signaling in vascular development and physiology. Development 134 (15): 2709–2718. PMID 17611219. DOI: 10.1242/dev.004184.
- ↑ Sato, T, Tozawa, Y, Deutsch, U, Wolburg-Buchholz, K, Fujiwara, Y (1995). Distinct roles of the receptor tyrosine kinases Tie1 and Tie2 in blood vessel formation. Nature 376 (6535): 70–74. PMID 7596437. DOI: 10.1038/376070a0.
- ↑ Janes, P, Saha, N, Barton, WA, Kolev, MV, Wimmer-Kleikamp, SH (2005). Distinct roles of the receptor tyrosine kinases Tie1 and Tie2 in blood vessel formation. Cell 123 (2): 291–304. PMID 16239146. DOI: 10.1016/j.cell.2005.08.014.
- ↑ Kumar, P, Amin, MA, Harlow, LA, Polverini, PJ, Koch, AE (2003). Src and phosphatidylinositol 3-kinase mediate soluble E-selectin induced angiogenesis. Blood 101 (10): 3960–3968. PMID 12522014. DOI: 10.1182/blood-2002-04-1237.
- ↑ Roman, M, Sironi, M, Toniatti, C, Polentarutti, N, Fruscella, P (1997). Role of IL-6 and its soluble receptor in induction of chemokines and leukocyte recruitment. Immunity 6 (3): 315–325. PMID 9075932. DOI: 10.1016/S1074-7613(00)80334-9.
- ↑ Basil, J, Holmbeck, K, Bugge, TH, Gutkind, JS (2007). MT1-MMP controls tumor induced angiogenesis through the release of semaphoring 4D. J. Biol. Chem. 282 (9): 6899–6905. PMID 17204469. DOI: 10.1074/jbc.M609570200.
- ↑ (en) Stefan F Lichtenthaler. Ectodomain shedding of the amyloid precursor protein: cellular control mechanisms and novel modifiers. Neurodegenerative Diseases 3 (4-5): 262-269. ISSN: 1660-2854. PMID 17047366. DOI: 10.1159/000095265. Wikidata

- ↑ Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation. 2007, geraadpleegd op 30 mei 2024.
- bronvermelding
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Ectodomain op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Proteases in angiogenesis#Ectodomain shedding op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Ectodomain-Shedding op de Duitstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.