Complex van metaal met salen
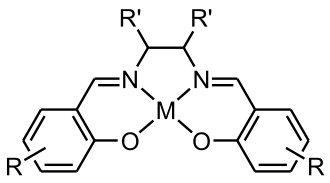
Een complex van een metaal met salen is een coördinatieverbinding tussen een metaal-kation en een ligand gebaseerd op salen, het dubbel-condensatieproduct van salicylaldehyde en ethyleendiamine. Naast de twee hier genoemde uitgangsstoffen is een heel scale aan verwante verbindingen bruikbaar, zolang het maar een β-hydroxycarbonyl en een vicinaal diamine betreft. Het klassieke voorbeeld van een dergelijke verbinding is het kobalt(II)-complex van salen: salcomine, wat vaak als genoteerd wordt.[1] De complexen worden bestudeerd als katalysatoren, zowel technisch als biologisch. In het laatste geval gaat het dan om modelverbindingen voor (co)enzymen.[2][3]
Het ligand zonder het metaalion, genoteerd als of , beschikt over twee relatief zure fenolische hydroxylgroepen. De actieve ligand is de (dubbel) geconjugeerde base, ontstaan door het afstaan van de twee fenolische protonen. Het metaal vormt doorgaans vier coördinatieve bindingen, twee naar zuurstof en twee naar stikstof.
Synthese en complexen
Het salen-anion vormt complexen met de meeste overgangsmetalen. Deze complexen ontstaan meestal uit de reactie van (de "pro-ligand") met een bron van het metaal die bovendien beschikte over ingebouwde basen als alkoxide, amides of acetaten. Vaak werkt een metaalhalogenide ook als bron voor het metaal. De pro-ligand kan voorafgaand aan de koppeling met behulp van een niet-nucleofiele base als natriumhydride gedeprotoneerd worden. Zo wordt de Jacobsen katalysator bereid uit de pro-ligand en mangaanacetaat.[4]
Structuur
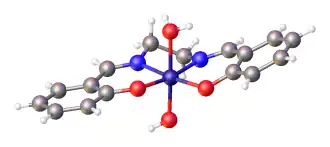
Salen-complexen met d8 metaal-ionen, zoals het -ion, vertonen meestal een vierkant planaire moleculaire geometrie met lage spin.
Andere metalen kunnen additionele liganden hebben boven en/of onder het vlak van de stikstof- en zuurstof-atomen van de salen-ligand. Een voorbeeld van een complex met één extra ligand is vanadyl-salen, .[6] De salen ligand vormt in dit complex de basishoeken van een vierzijdige piramide, het zuurstof-atoom bevindt zich op de top van de piramide. Complexen met twee extra liganden, zoals , naast salen zijn ook chloride en pyridine liganden, hebben doorgaans een octaëdrische moleculaire geometrie. Gewoonlijk is het -centrum van het molecuul relatief vlak, hoewel dit betekent dat het ethyleen-deel van het molecuul in een wat verwrongen conformatie wordt geforceerd: om echt vlak te zijn zouden de waterstof-atomen een geëclipseerde conformatie moeten aannemen, wat energetisch ongunstig is. Het molecuul "ontsnapt" door een de C2-brug een beetje te wringen, waardoor de waterstof-atomen net iets meer ruimte krijgen. Er zijn echter voorbeelden bekend waarbij de niet-salen liganden het N2O2-deel verhinderen een vlakke structuur aan te nemen.[7] ER is geen bewijs dat salen zich als een noninnocent ligand gedraagt.
Reacties
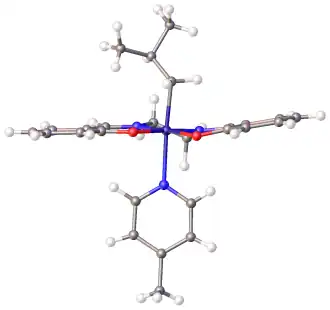
Het pyridine-adduct van het kobalt(II)-complex (salcomine) heeft een vierkante piramide-structuur. Het fungeert als een zuurstofsdrager: het vormt een labiele binding met zuurstof waarbij een octaedrisch complex ontstaat.[9][10]
De naam "salen-ligand" wordt ook gebruikt voor andere tetradentaat liganden met een vergelijkbare structuur. Zo heeft salpn een methylgroep op de ethyleenbrug.
Geschiedenis
Tsumaki beschreef de eerste metal-salen complexen in 1938. Hij stelde vast dat het kobalt(II)-complex in staat was zuurstof, O2 reversibel te binden. Dit leidde tot een uiygebreid onderzoek naar demogelijkheden van salen en verwante synthetische kobaltcomplexen voor opslag en transport van zuurstof.[1] Een aantal aspecten van kabalt-salen-complexen vertonen overeenkomst met vitamine B12.
Verwante complexen
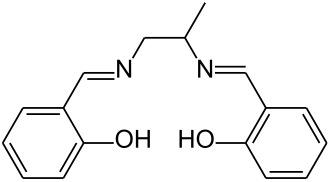
Gesubstitueerde salencomplexes
-Jacobsen's_catalyst_(cropped).png)
Complexen met de oorspronkelijke salen-ligand zijn slecht oplosbaar in organische oplosmiddelen. Sustituenten verhogen de oplosbaarheid van het complex. Salpn, waarbij in plaats van 1,2-diamino-ethaan gebruik is gemaakt van 1,2=diaminopropaan is hier een voorbeeld van. Het wordt gebruikt als additief in brandstoffen om metalen, afkomstig van motersluitage, te deactiveren.[11] De aanwezigheid van omvangrijke substituenten in de buurt van het katalytisch centrum kunnen effect hebben op het katalytisch effect en voorkomen dimerisatie van de katalysator. Salen-liganden op basis van 3,5-di(tert-butyl)salicylaldehyde worden in deze rol gebruikt. De substituenten zorgen er ook voor dat de verbinding beter oplosbaar wordt in apolaire verbindingen zoals pentaan. Chirale "salen"-liganden kunnen gemaakt worden op basis van op de juiste manier gesubstitueerde di-amines, de fenylring, of beide.[12] Een voorbeeld is het condensatieproduct van C2-symmetrische trans-1,2-diaminocyclohexane met 3,5-di-tert-butylsalicylaldehyde. Chirale liganden kunnen een belangrijke rol spelen in asymmetrische syntheses zoals de Jacobsen epoxidatie:[4][12][13]
Een mangaan(II)-salencomplex katalyseert de asymetrische epoxidatie van alkenen.[4] Met behulp van een analoog kobaly(III)-complex is het mogelijk een recemisch mengsel te scheiden door selectief een van de epoxide-isomeren te hydrolyseren.[14] Ook aluminium als gecomplexeerd metaal levert een bruikbare chirale katalysator. In vervolgonderzoek werd gevonden dat salen-complexen van chroom(III) en kobalt(III) als katalysator actief waren in de reactie tussen koolstofdioxide en epoxides waarbij polycarbonaten ontstonden.[15]
Complexen met salen-achtige liganden
De naam "salen" of "salen-achtig" wordt ook gebruikt voor andere dan de oorspronkelijke verbinding. Als er twee tamelijk zure hydroxylgroepen en twee Schiff-bases in het molecuul aanwezig zijn die met een centraal metaal-ion vijf- en zesringen kunnen vormen.
| Afkorting | diamine | aldehyde | chiraal |
|---|---|---|---|
| salen | 1,2-diamino-ethaan | salicylaldehyde | nee |
| salpn | 1,2-diaminopropaan | salicylaldehyde | ja |
| trans-1,2-diaminocyclohexaan | salicylaldehyde | ja | |
| salph | 1,2-diaminobenzeen | salicylaldehyde | nee |
Salqu-kopercomplexen[Opm. 1] zijn onderzocht als katalysator in oxidatie-reacties.[16]
salan en salalen verwijzen naar liganden waarin een of beide stikstof-atomen verzadigd zijn, het zijn eerder amines dan imines. De verbindingen hebben meer bewegingsmogelijkheden en het coördinerende deel van het molecuul is elektronenrijker dan de overeenkomstige salen-verbindingen.[17][18] Salanen kunnen gesynthetiseerd worden door het juiste amine met een fenolisch alkylhalogenide te laten reageren. De half-salen-liganden beschikken slechts over een salicylimine-groep, zou ontstaan bij de reactie van salicylaldehyde met een mono-amine.[19]
Acacen liganden
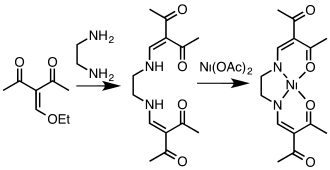
Een nauw aan de salen-liganden verwante groep wordt gevormd door de acacen tetradentaat-liganden. Deze ontstaan in de reactie van acetylaceton met 1,2-diamino-ethaan.[20]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Metal salen complex op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Opmerkingen
- ↑ Salqu verwijst waarschijnlijk naar een amine met de naam 2-Quinoxalinol. Helaas geeft noch de schrijver van het Engelstalige artikel, noch Wikipedia of Google (28 april 2025) nadere informatie over deze verbinding.
Algemene informatie over dit onderwerp
- Hazra, S.; Mohanta, S. (2019). "Metal–tin derivatives of compartmental Schiff Bases: Synthesis, structure and application". Coordination Chemistry Reviews. 395:1-24. https://doi.org/10.1016/j.ccr.2019.05.013
- McGarrigle, Eoghan M., Gilheany, Declan G. (2005). Chromium− and Manganese−salen Promoted Epoxidation of Alkenes. Chemical Reviews 105 (5): 1563–1602. PMID 15884784. DOI: 10.1021/cr0306945.
- `Bandini, Marco; Cozzi, Pier Giorgio; Umani-Ronchi, Achille (2002). [Cr(Salen)] as a 'bridge' between asymmetric catalysis, Lewis acids and redox processes. Chemical Communications (9), pag.: 919–927. PMID: 12123051. DOI: 10.1039/b109945k.
- Verwijzingen in de tekst
- ↑ a b (de) Tsumaki, T. (1938). Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan 13 (2), pag.: 252–260. DOI: 10.1246/bcsj.13.252.
- ↑ Baleizão, Carlos; Garcia, Hermenegildo (2006). Chiral Salen Complexes: An Overview to Recoverable and Reusable Homogeneous and Heterogeneous Catalysts. Chemical Reviews 106 (9), pag.: 3987–4043. PMID: 16967927. DOI: 10.1021/cr050973n.
- ↑ Decortes, Antonello; Castilla, Ana M.; Kleij, Arjan W. (2010). Salen-Complex-Mediated Formation of Cyclic Carbonates by Cycloaddition of CO2 to Epoxides. Angewandte Chemie International Edition 49 (51), pag.: 9822–9837. PMID: 20957709. DOI: 10.1002/anie.201002087.
- ↑ a b c Larrow, J. F., Jacobsen, E. N. (2004). (R,R)-N,N'-Bis(3,5-Di-tert-Butylsalicylidene)-1,2-Cyclohexanediamino Manganese(III) Chloride, A Highly Enantioselective Epoxidation Catalyst. Org.Synth. coll.vol: 10, pag.: 96.
- ↑ Coggon, P.; McPhail, A. T.; Mabbs, F. E.; Richards, A.; Thornley, A. S. (1970). Preparation, Magnetic, and Electronic Spectral Properties of Some Chromium(III)–NN′-Ethylenebis(salicylideneiminato) Complexes: Crystal and Molecular Structure of N,N′-Ethylenebis(salicylideneiminato)diaquochromium(III) Chloride. J. Chem. Soc. A, pag.: 3296–3303. DOI: 10.1039/j19700003296.
- ↑ Nakajima, Kiyohiko; Kojima, Katsuhide; Kojima, Masaaki; Fujita, Junnosuke (1990). Preparation and Characterization of Optically Active Schiff Base-Oxovanadium(IV) and -Oxovanadium(V) Complexes and Catalytic Properties of These Complexes on Asymmetric Oxidation of Sulfides into Sulfoxides with Organic Hydroperoxides. Bulletin of the Chemical Society of Japan 63 (9), pag.: 2620–2630. DOI: 10.1246/bcsj.63.2620.
- ↑ Lauffer, Randall B.; Heistand, Robert H.; Que, Lawrence (1983). Dioxygenase models. Crystal Structures of the 2,4-Pentanedionato, Phenanthrenesemiquinone, and Catecholato Complexes of N,N′-Ethylenebis(salicylideneaminato)iron(III). Inorganic Chemistry 22, pag.: 50–55. DOI: 10.1021/ic00143a013.
- ↑ Huilan, Chen; Deyan, Han; Tian, Li; Hong, Yan; Wenxia, Tang; Jian,; Peiju,; Chenggang, (1996). Synthesis and Crystal Structure of Organocobalt(III) Complexes with Secondary Alkyls or Bulky Schiff Base Equatorial Ligands. Inorganic Chemistry 35 (6), pag.: 1502–1508. PMID: 11666365. DOI: 10.1021/ic940516h.
- ↑ Appleton, T. G. (1977). Oxygen Uptake by a Cobalt(II) Complex. J. Chem. Educ. 54 (7), pag.: 443. DOI: 10.1021/ed054p443.
- ↑ Yamada, Shoichiro (1999). Advancement in stereochemical aspects of Schiff base metal complexes. Coordination Chemistry Reviews 190–192, pag.: 537–555. DOI: 10.1016/S0010-8545(99)00099-5.
- ↑ Dabelstein, W.; Reglitzky A.; Schutze A.; Reders, K.. Ullmann's Encyclopedia of Industrial Chemistry: Automotive Fuels (Wiley-VCH: Weinheim:). DOI: 10.1002/14356007.a16_719.pub2.
- ↑ a b Cozzi, Pier Giorgio (2004). Metal–Salen Schiff base complexes in catalysis: Practical aspects. Chem. Soc. Rev. 33 (7), pag.: 410–21. PMID: 15354222. DOI: 10.1039/B307853C.
- ↑ Yoon, TP, Jacobsen, EN (2003). Privileged Chiral Catalysts. Science 299 (5613), pag.: 1691–1693. PMID: 12637734. DOI: 10.1126/science.1083622.
- ↑ Makoto Tokunaga, Jay F. Larrow, Fumitoshi Kakiuchi, Eric N. Jacobsen (1997). Asymmetric Catalysis with Water: Efficient Kinetic Resolution of Terminal Epoxides by Means of Catalytic Hydrolysis. Science 277 (5328), pag.: 936–938. PMID: 9252321. DOI: 10.1126/science.277.5328.936.
- ↑ D. J. Darensbourg (2007). Making Plastics from Carbon Dioxide: Salen Metal Complexes as Catalysts for the Production of Polycarbonates from Epoxides and CO2. Chemical Reviews 107 (6), pag.: 2388–2410. PMID: 17447821. DOI: 10.1021/cr068363q.
- ↑ Wu, Xianghong, Gorden, A. V. E. (2009). 2-Quinoxalinol Salen Copper Complexes for Oxidation of Aryl Methylenes. Eur. J. Org. Chem. 2009 (4), pag.: 503–509. DOI: 10.1002/ejoc.200800928.
- ↑ Atwood, David A.; Remington, Michael P.; Rutherford, Drew (1996). Use of the Salan Ligands to Form Bimetallic Aluminum Complexes. Organometallics 15 (22), pag.: 4763. DOI: 10.1021/om960505r.
- ↑ Berkessel, Albrecht; Brandenburg, Marc; Leitterstorf, Eva; Frey, Julia; Lex, Johann; Schäfer, Mathias (2007). A Practical and Versatile Access to Dihydrosalen (Salalen) Ligands: Highly Enantioselective Titanium. In Situ Catalysts for Asymmetric Epoxidation with Aqueous Hydrogen Peroxide. Adv. Synth. Catal. 349 (14–15), pag.: 2385. DOI: 10.1002/adsc.200700221.
- ↑ Pang, Xuan; Duan, Ranlong; Li, Xiang; Sun, Zhiqiang; Zhang, Han; Wang, Xianhong; Chen, Xuesi (2014). Synthesis and characterization of half-salen complexes and their application in the polymerization of lactide and ε-caprolactone. Polymer Chemistry 5 (23), pag.: 6857–6864. DOI: 10.1039/C4PY00734D.
- ↑ a b Weber, Birgit, Jäger, Ernst-G. (2009). Structure and Magnetic Properties of Iron(II/III) Complexes with -Coordinating Schiff Base-Like Ligands. Eur. J. Inorg. Chem.. DOI: 10.1002/ejic.200990003.