Geconjugeerde base
| ZUREN en BASEN |
|---|
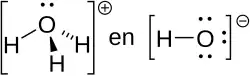 |
| Algemene begrippen |
| pH Zuur-basereactie Zuur-basetitratie Zuurconstante Buffer Waterevenwicht Hammett-zuurfunctie |
| Zuren |
|
Sterk · Zwak · Lewiszuur · Anorganisch zuur · Organisch zuur · Superzuur · Oxozuur · Halogeenzuurstofzuur |
| Basen |
|
Sterk · Zwak · Lewisbase · Organische base |
| Portaal |
Een geconjugeerde base is de base die ontstaat bij ioniseren van een zuur, in water. Uit het zuur-base evenwicht volgt dan hoe sterker het zuur is, hoe zwakker de base, en omgekeerd. Wanneer de K-waarden van het zuur en de geconjugeerde base vermenigvuldigd worden komt er altijd de K-waarde van water uit. In formule: Kz · Kb = Kw. Altijd is Kw = 10−14. Een zwak zuur heeft een sterk geconjugeerde base. Zwakke zuren of basen met het overeenkomstige zout vormen een bufferoplossing.
Enkele voorbeelden zijn waterstoffluoride HF met als geconjugeerde base F−, diwaterstofcarbonaat H2CO3 met HCO3− en waterstofchloride HCl met Cl−.
Hoe sterker het zuur, hoe zwakker de geconjugeerde base: een sterk zuur zal volledig dissociëren, maar de geconjugeerde base zal weinig dissociëren. Dat is dus een zwakke base. Hetzelfde geldt voor een geconjugeerd zuur, maar dan omgekeerd.