Salcomine
| Kobalt(II)salen[1] | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
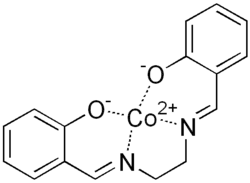
| ||||
Structuurformule van Salcomine
| ||||
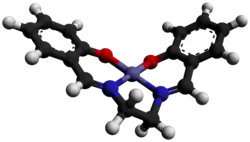
| ||||
Ruimtelijk model van een salcomine-molecuul
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Andere namen |
| |||
| Molmassa | 325,21 g/mol | |||
| CAS-nummer | 14167-18-1 | |||
| PubChem | 26517 | |||
| Wikidata | Q3469655 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| P-zinnen | P261 - P264 - P271 - P280 - P304+P340+P312 - P332+P313 - P337+P313 - P362+P364 - P403+P233 - P501 | |||
| EG-Index-nummer | 238-012-5 | |||
| ||||
Salcomine is een coördinatieverbinding, opgebouwd uit de salen-ligand en kobalt als centraal atoom. Het vlakke complex, en een aantal van zijn derivaten, zijn in staat zuurstof efficiënt te binden. De complexen worden ook toegepast als redox-katalysatoren.[4]
Etymologie
De naam salcomine is een Porte-manteauwoord, opgebouwd uit de namen van de drie bestanddelen ervan: salicylaldehyde, cobalt (in de Engelse spelling met een "C") en ethyleendi-amine.[5]
Synthese
Salcomine is een commercieel verkrijgbare stof (ongeveer € 100,00 per gram - mei 2025). In het laboratorium is de synthese relatief eenvoudig: na de vorming van salen in ethanol kan door toevoegen van een kobalt(II)-bron, vaak kobalt(II)acetaat, de stof verkregen worden.[6][7]
Eigenschappen
[Opm. 1] Het complex bezit een vlakke, vierkante structuur rond het metaal-atoom. De verbinding is paramagnetisch, het effectieve magnetisch moment bij kamertemperatuur bedraagt 2,28[8] tot 2,75,[9] gemeten in Bohrmagneton.
-
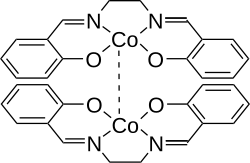 Aktive Form von Salcomin
Aktive Form von Salcomin -
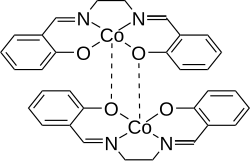 Inaktive Form von Salcomin
Inaktive Form von Salcomin
Salcomine vormt als vaste stof dimeren en komt voor in een actieve en een inactieve vorm. In beide vormen is het kobalt-ion vijfvoudig gecoördineerd. In de actieve vorm is het kobalt-ion in het andere molecuul de vijfde ligand, in de inactieve vorm is dat een van de zuurstof-atomen uit het andere molecuul.[7] De bijzondere eigenschap van de actieve vorm is, dat deze in staat is zuurstof uit de lucht op te nemen (tot 4,9 gew.%[Opm. 2]) en dat bij verwarming tot 50 - 60 °C weer afstaat.[10] Deze eigenschap betekent wel dat salcomine onder een beschermende atmasfeer bewaard moet worden.[11]
De inactieve vorm kristalliseert in ruimtegroep C2/c met de roosterconstanten a = 2638,0(5) pm, b = 710,5(5) Å, c = 1447,0(5) Å, β = 97,96(2)° und Z = 8.[12]
Naast de dimere vormen is er ook een kristallijn monomeer bekend, hierbij is een molecuul chloroform opgenomen in het kristal.[13]
Salcomine is zowel een lewiszuur als een reductor.
Verschillende derivaten geven met zuurstof complexen van het type en .[4]
Toepassingen
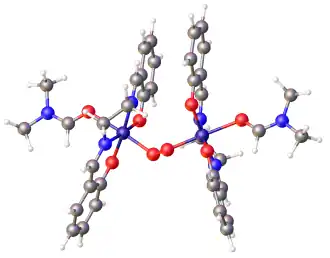
De publicatie in 1938 dat salcomine in staat was O2 reversibel kan binden[15] heeft aanleiding gegeven tot een intensieve zoekactie naar mogelijkheden van deze en aanverwante verbindingen voor de opslag en het vervoer van zuurstof. Gesolvateerde salcomine-derivaten, zoals het hiernaast weergegeven zuurstofhoudende complex met naast zuurtstof (de rode ballen centraal in het complex) de salen-ligand ook een DMF-ligand (de links en rechts uitstekende takjes) gebonden aan elk kobalt-ion. Per 2 salcomine-moleculen wordt één zuurstof-molecuul gebonden.
Salcomine katalyseert de oxidatie van 2,6-digesubstitueerde fenolen door zuurstof.[16]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Salcomine op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Salcomin op de Duitstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Opmerkingen
- ↑ Deze paragraaf is ontleend aan de Duitse Wikipedia.
- ↑ Opmerking van de vertaler: Dit betekent dat bij kamertemperatuur het evenwicht volledig aan de kant van het zuurstofgebonden complex ligt:
Het betekent bovendien dat het mogelijk is 32 gram zuurstof, dat gasvormig een volume heeft van 22,4 L (dit is het Molair volume van een ideaal gas onder standaard-omstandigheden), op te slaan in ongeveer 600 mL. Dit laatste getal is een schatting: de dichtheid van veel organische stoffen waar ook zuurstof en stikstof in voorkomen is iets hoger dan 1. Ook de aanwezigheid van kobalt zal de dichtheid iets verhogen. De molaire massa van het dimeer met zuurstof (650 + 32 = 682 g/mol) leidt dan tot een molair volume van ongeveer 600 mL ).
Verwijzingen in de tekst
- ↑ N,N'-Bis(salicylidene)ethylenediaminocobalt(II) at Sigma-Aldrich
- ↑ SAFETY DATA SHEET (27 november 2021). Geraadpleegd op 15 december 2021.
- ↑ Oxford MSDS
- ↑ a b Shoichiro Yamada "Advancement in stereochemical aspects of Schiff base metal complexes" Coordination Chemistry Reviews 1999, volume 190–192, 537–555.
- ↑ Margot Becke-Goehring, Harald Hoffmann: Komplexchemie. Vorlesungen über Anorganische Chemie Von Margot Becke-Goehring. Springer, 2013, ISBN 978-3-642-87215-0, 2.10, S. 93–94 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 20. März 2019]).
- ↑ Appleton, T. G. (1977). Oxygen Uptake by a Cobalt(II) Complex. J. Chem. Educ. 54 (7), pag.: 443. DOI: 10.1021/ed054p443.
- ↑ a b (1977). Oxygen uptake by a cobalt(II) complex. An undergraduate experiment. Journal of Chemical Education 54 (7), pag.: 443–444. DOI: 10.1021/ed054p443.
- ↑ (1970). Structure of cobalt(II) complexes with quadridentate schiff bases in solution and the solid state. Inorganic Chemistry 9 (4), pag.: 966–968. DOI: 10.1021/ic50086a057.
- ↑ (2002). Some new cobalt(II) complexes, Synthesis, characterization and thermal studies. Journal of Thermal Analysis and Calorimetry 69 (6), pag.: 607–616.
- ↑ Salcomine in de database van Römpp
- ↑ SDS in de Online catalogus van Sigma Aldrich voor N,N′-Bis(salicylidene)ethylenediaminocobalt(II) (Salcomine), geraadpleegd op 3 mei 2025.
- ↑ (1971-07). Crystal structure of the oxygen-inactive form of bis(salicylaldehyde)ethylenediiminecobalt(II). Inorganic Chemistry 10 (7), pag.: 1498–1500. DOI: 10.1021/ic50101a036.
- ↑ Schaefer, W. P., Marsh, R. E. (1969). Oxygen-Carrying Cobalt Compounds. I. Bis(salicylaldehyde)ethylenediiminecobalt(II) Monochloroformate. Acta Crystallographica Section B 25 (9), pag.: 1675–1682. DOI: 10.1107/S0567740869004547.
- ↑ M. Calligaris, G. Nardin, L. Randaccio, A. Ripamonti (1970). Structural Aspects of the Synthetic Oxygen-Carrier NN'-Ethylenebis(Salicylideneiminato)cobalt(II): Structure of the Addition Compound with Oxygen Containing Dimethylformamide. J. Chem. Soc. A, pag.: 1069. DOI: 10.1039/j19700001069.
- ↑ Tokuichi Tsumaki (1938). Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan 13 (2), pag.: 252–260. DOI: 10.1246/bcsj.13.252.
- ↑ C. R. H. I. De Jonge, H. J. Hageman, G. Hoentjen, W. J. Mijs (1988). Oxidation with Bis(Salicylidene)ethylenediiminocobalt(II) (Salcomine): 2,6-Di-''tert''-butyl-''p''-benzoquinone. Org.Synth. coll.vol: 6, pag.: 412.
