Bètacel

_and_type_2_diabetic_(T2D)_beta_cells._Cropped_B_(ND).jpg)
Bètacellen (β-cellen) zijn gespecialiseerde endocriene cellen die zich in de eilandjes van Langerhans van de alvleesklier bevinden en die verantwoordelijk zijn voor de productie en afgifte van insuline en amyline.[1] De vorm van bètacellen zijn afgeknotte piramides die zich clusteren rond de bloedvaten van de eilandjes. Bètacellen hebben een gemiddelde diameter van 10 micrometer (µm).[2] De kern van de bètacel bevindt zich nabij de basis en het insulinegranulaat bevindt zich boven de kern.[3]
Bètacellen vormen ongeveer 50–70% van de cellen in de eilandjes van Langerhans van de mens en spelen een cruciale rol bij het handhaven van de bloedglucosespiegel.[4] Een gemiddeld eilandje van Langerhans bevat in totaal 1000 tot 3000 cellen. Schattingen suggereren dat een muizenalvleesklier 1 × 106 bètacellen (1 mg bètacellen) kan bevatten en een gemiddelde menselijke alvleesklier 1 × 109 bètacellen (1 g bètacellen).[5]
Problemen met bètacellen kunnen leiden tot aandoeningen zoals diabetes.[6]
Elektronenmicroscopische structuur
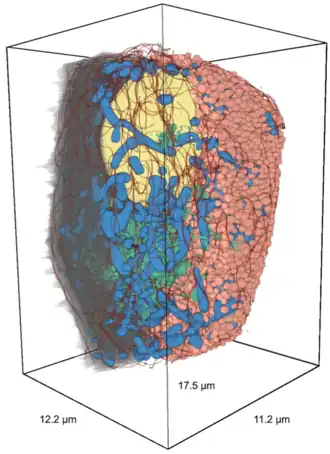
Bètacellen hebben een gemiddelde diameter van 10 micrometer (μm) en een lengte van ~17 μm. Het totale membraanoppervlak van een bètacel werd geschat op ≈973 vierkante micrometer (µm²). Het berekende volume van een bètacel zou gemiddeld ≈1430 kubieke micrometer (µm³) zijn.[7][8]
Insulinegranulaat
De insuline-achtige granulaat van bètacellen wordt gekenmerkt door elektronendichte sferoïden.
- Onrijpe "grijze" granulaat (IG): Deze granulaat heeft een homogeen uiterlijk zonder celkern en bevat pro-insuline die nog niet volledig is verwerkt.
- Rijpe granulaat (MG): Een donker, onregelmatig gevormd, dicht centrum en een heldere perifere halo (de inhoud scheidt zich van het begrenzende membraan na de fixatie die wordt gebruikt bij elektronenmicroscopie), die er wit (elektrodoorlatend) uitziet door de resulterende lege ruimte. De grootte van rijpe insulinegene granulaat (MG) is ongeveer 300 nanometer (nm) en hun gemiddelde aantal wordt geschat op ~10.000 in elke bètacel.[2][9]
- Een fractie van de MG-granula, gelegen zeer dicht bij het celmembraan, vertegenwoordigt een populatie die klaar is voor exocytose.
Bètacelgranulen bevatten ongeveer 20 picogram (pg) insuline per cel.[2]
Celkern
De celkern van de bètacel is duidelijk zichtbaar omdat deze wordt gedomineerd door minder compact DNA (euchromatine), dat de genen bevat die actief en permanent door de cel worden getranscribeerd (genexpressie).
Het berekende volume van de muizencelkern ligt tussen de 110 en 168 kubieke micrometer (µm), wat 14-16% van het totale celvolume vertegenwoordigt.[10] [8]
Golgicomplex
Het golgicomplex van de bètacel is verantwoordelijk voor de modificatie en distributie van eiwitten (pro-insuline) die in het endoplasmatisch reticulum zijn gesynthetiseerd en omringt deze met een membraan, waardoor vesikels met insulinekorrels ontstaan die buiten de cel worden uitgescheiden. Het volume van het golgicomplex van de bètacel bedraagt tussen de 18 en 22 µm3, wat 0,90 tot 2,20% van het celvolume is.[8]
Celmembraan
De polariteit van insuline-afscheidende cellen wordt al bediscussieerd sinds de speculatie over hun embryonale oorsprong. Menselijke bètacellen komen in contact met de capillairen van de eilandjes en zijn structureel en functioneel gepolariseerd. Bètacellen hebben twee of zelfs drie polen.[11] [12] [13]
Celmembraanspecialisaties tussen endocriene cellen zijn gap junctions of zonula occludens.[14] [15]
Bètacellen staan bekend om hun overvloedige microvilli, die het fluweelachtige uiterlijk van hun oppervlak bepalen.[16][3]
Cilium
Het primaire cilium van de bètacel is lang en enkelvoudig, 5–10 micrometer (µm) lang en 0,2–0,3 µm (200–230 nanometer (nm)) in diameter. Het komt uit celoppervlakken die grenzen aan andere cellen en tegenover die welke in contact komen met bloedvaten. Het steekt uit in een "canaliculus" van de intercellulaire ruimte, gevormd door drie of vier aangrenzende cellen, die bekleed is met microvilli.[17] [18] Er wordt verondersteld dat deze ruimte wordt gevormd door het apicale gebied van de bètacellen, gelegen in een ruimtelijk domein omgeven door zonula occludens.[12][13]
Functie
De functie van bètacellen draait voornamelijk om de synthese en secretie van hormonen, met name insuline en amyline. Beide hormonen zorgen er via verschillende mechanismen voor dat de bloedglucosespiegel binnen een nauw, gezond bereik blijft.[19] Insuline vergemakkelijkt de opname van glucose door cellen, waardoor ze het kunnen gebruiken als energie of opslaan voor toekomstig gebruik.[20] Amyline helpt de snelheid te reguleren waarmee glucose na een maaltijd in de bloedbaan terechtkomt, waardoor de opname van voedingsstoffen wordt vertraagd door het legen van de maag te remmen.[21]
Insulinesynthese
Bètacellen zijn de enige plaats waar insuline wordt gesynthetiseerd bij zoogdieren.[22] Omdat glucose de insulinesecretie stimuleert, verhoogt het tegelijkertijd de pro-insulinebiosynthese door middel van translationele controle en verbeterde transcriptie.[19][23]
Het insulinegen wordt eerst getranscribeerd naar mRNA en vertaald naar prepro-insuline.[19] Na translatie bevat de prepro-insulineprecursor een N-terminus signaalpeptide dat translocatie naar het ruw endoplasmatisch reticulum (RER) mogelijk maakt.[24] In het RER wordt het signaalpeptide gekliefd tot pro-insuline.[24] Vervolgens vindt pro-insulinevouwing plaats, waarbij drie zwavelbrugbindingen worden gevormd.[24] Na de eiwitvouwing wordt pro-insuline getransporteerd naar het golgicomplex en komt het terecht in onrijpe insulinekorrels, waar pro-insuline wordt gekliefd tot insuline en C-peptide.[24] Na rijping houden deze secretoire vesikels insuline, C-peptide en amyline vast totdat calcium de exocytose van de korrelinhoud activeert.[19]
Door middel van translationele verwerking wordt insuline gecodeerd als een precursor van 110 aminozuren, maar uitgescheiden als een eiwit van 51 aminozuren.[24]
Insuline afgifte
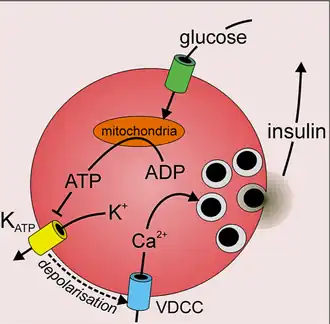

Elke insuline-afscheidende bètacel bevat tussen de 5.000 en 13.000 insuline-afscheidende granulen. Bij een volwassen mens geven bètacellen tussen de 30 en 70 eenheden insuline per dag af, afhankelijk van het lichaamsgewicht.[2] Acute stimulatie van de insulinesecretie omvat het vrijkomen van granulen die aanwezig zijn in het celmembraan. Langdurige stimulatie vereist de mobilisatie van reservegranulen via een mechanisme dat afhankelijk is van het granuletransportmechanisme.[25].De insuline die wordt afgegeven door de secretoire vesikels wordt rechtstreeks in de tussenliggende ruimte afgegeven, vanwaar het de gefenestreerde (met poriën) capillairen van de eilandjes van Langerhans en vervolgens de poortader bereikt.[26]
De belangrijkste factor die de afgifte van insuline vanuit de alvleesklier bepaalt, is de glucoseconcentratie, de bloedsuikerspiegel in het bloed. Andere stimulerende factoren zijn het gehalte van in het bloed aanwezige aminozuren, vetzuren en de werking van het parasympathische zenuwstelsel. Wanneer de bloedglucosespiegel stijgt, gaat glucose de bètacellen binnen via een membraaneiwit, de glucosetransporter GLUT-2. Glucose wordt in de bètacel via de normale weg, door middel van celademhaling omgezet. Hierbij spelen glycolyse en de citroenzuurcyclus een rol. Het leidt ertoe dat de concentratie ATP in de bètacel stijgt. Het gevormde ATP blokkeert kalium-ATP-kanalen, waardoor de celmembraan depolariseert en het spanningsafhankelijk calciumkanaal zich opent. De calciumconcentratie in de cel stijgt en dat leidt ertoe dat insuline wordt afgegeven. Consumptie van veel suiker, bijvoorbeeld door frisdrank, leidt tot de productie van insuline.
Fysiologie van bètacellen
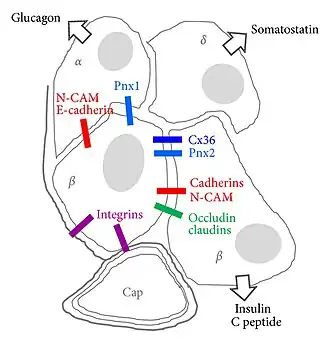
Bètacellen bereiken een nauwkeurige controle van de insulinesecretie door middel van uitgebreide cel-celcommunicatie met de andere celtypen in het eilandje van Langerhans, met name de glucagonproducerende alfacellen en de somatostatineproducerende deltacellen.[27] In bètacellen is de stijging van de bloedglucosespiegel (glycemie) na voedselinname direct gekoppeld aan insulineafgifte. Insulineafgifte is glucoseafhankelijk en wordt, naar analogie van de excitatie-contractiekoppeling in spieren, het stimulus-secretiekoppelingsmechanisme genoemd.
Diabetes
Tegenwoordig wordt het ontstaan van diabetes nog wat beter begrepen en klasseert men diabetes in een β-cel-destructieve diabetes (type 1), en β-cel-intacte diabetes (type 2). Aangezien type 2, door de westerse leefstijl - overgewicht, weinig lichaamsbeweging, steeds vaker bij mensen van onder de 50 optreedt, is de term ouderdomsdiabetes niet meer van toepassing.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Beta cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Célula beta op de Spaanstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Dolenšek J, Rupnik MS, Stožer A (2 januari 2015). Structural similarities and differences between the human and the mouse pancreas. Islets 7 (1): e1024405. PMID 26030186. PMC 4589993. DOI: 10.1080/19382014.2015.1024405.
- ↑ a b c d Marchetti P.; Bugliani M.; De Tata V.; Suleiman M.; Marselli L. (2017). «Pancreatic Beta Cell Identity in Humans and the Role of Type 2 Diabetes». Frontiers in Cell and Developmental Biology (Front. Cell Dev. Biol.) (REVISIÓN). Epigenomics and Epigenetics (Frontiers (editorial)) 5 (55). Consultado el 4 de febrero de 2023.
- ↑ a b Geron E.; Boura-Halfon S.; Schejter E.D.; Shilo B-Z. (2015). «The Edges of Pancreatic Islet β Cells Constitute Adhesive and Signaling Microdomains». Cell Reports (en inglés) 10 (3): P317-325. doi:10.1016/j.celrep.2014.12.031. Consultado el 28 de febrero de 2023]
- ↑ Chen C, Cohrs CM, Stertmann J, Bozsak R, Speier S (September 2017). Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism 6 (9): 943–957. PMID 28951820. PMC 5605733. DOI: 10.1016/j.molmet.2017.06.019.
- ↑ Scharfmann R.; Rachdi L.; Ravassard P. (2013). «Concise Review: In Search of Unlimited Sources of Functional Human Pancreatic Beta Cells». Stem Cells Translational Medicine (REVISIÓN) (en inglés) (Academic.oup.) 2 (1): 61-67. doi:10.5966/sctm.2012-0120. Consultado el 4 de febrero de 2023
- ↑ Ashcroft FM, Rorsman P (March 2012). Diabetes mellitus and the β cell: the last ten years. Cell 148 (6): 1160–1171. PMID 22424227. PMC 5890906. DOI: 10.1016/j.cell.2012.02.010.
- ↑ Dean P.M. (1973). «Ultrastructural Morphometry of the Pancreatic β Cell» (PDF). Diabetologia (en inglés) (Springer-Verlag) 9: 115-119. Consultado el Febrero de 2023.
- ↑ a b c Müller A.; Schmidt D.; C. Shan Xu; Song Pang; Joyson Verner D’Costa; Kretschmar S.; Münster C.; Kurth T.; Jug F.; Weigert M.; Hess H.F.; Solimena M. (2021). 3D FIB-SEM reconstruction of microtubule–organelle interaction in whole primary mouse β cells. Journal of Cell Biology. Structural Biology 2021 (en inglés) 220 (2): e202010039. PMC 7748794.
- ↑ Leslie P. Gartner (2021). «cap.18: Aparato Digestivo: glándulas». Texto de histología: Atlas a color. Elsevier Health Sciences. p. 440. Consultado el 4 de febrero de 2023.
- ↑ Dean P.M. (1973). «Ultrastructural Morphometry of the Pancreatic β Cell» (PDF). Diabetologia (en inglés) (Springer-Verlag) 9: 115-119. Consultado el Febrero de 2023.
- ↑ Bonner-Weir S. (1988). «Morphological Evidence for Pancreatic Polarity of B-Cell Within Islets of Langerhans» (PDF). DIABETES 37 (5): 616-621. doi:10.2337/diab.37.5.616.
- ↑ a b Cottle L.; Gan W.J.; Gilroy I.; Samra J.S.; Gill A.J.; Loudovaris T.; Thomas H.E.; Hawthorne W.J.; Kebede M.A.; Thorn P. (2021). Structural and functional polarisation of human pancreatic beta cells in islets from organ donors with and without type 2 diabetes. Diabetologia 64: 618-629. DOI: 10.1007/s00125-020-05345-8.
- ↑ a b Gan W.J.; Zavortink M.; Ludick C.; Templin R.; Webb R.; Webb R.; Poronnik W.; Parton R.G..; Gaisano H.Y.; Shewan A.M.; Thorn P. (2017). Cell polarity defines three distinct domains in pancreatic β-cells. J Cell Sci. (en inglés) 130 (1): 143-151. PMID 26919978. PMC 5394774. DOI: 10.1242/jcs.185116.
- ↑ Orci L.; Unger R.H.; Renold A.E. (1973). «Structural coupling between pancreatic islet cells». Experientia (en francés) 29: 1015-1018. (requiere suscripción).
- ↑ Paolo MEDA; Alain PERRELET; Lelio ORCI (1979). «Increase of GAP junctions between pancreatic B-cells during stimulation of insulin secretion» (PDF). J. CELL BIOLOGY (The Rockefeller University Press) 82: 441-448.
- ↑ Polino A.J.; Sviben S.; Melena I.; Piston D.W.; Hughes J. (2023). Scanning electron microscopy of human islet cilia (PDF) (en inglés). bioRxiv. Consultado el 28 de febrero de 2023.
- ↑ Yamamoto M.; Kataoka K. (1986). «Electron microscopic observation of the primary cilium in the pancreatic islets». Arch Histol Jpn (PDF) (en inglés) (J-STAGE) 49 (4): 449-457. doi:10.1679/aohc.49.449.
- ↑ Iwanaga T.; Miki T.; Takahashi-Iwanaga H. (2011). «Restricted expression of somatostatin receptor 3 to primary cilia in the pancreatic islets and adenohypophysis of mice» (PDF). Biomed Res (en inglés) (J-STAGE) 32 (1): 73-81. PMID 21383513. doi:10.2220/biomedres.32.73. Consultado el 21 de marzo de 2023.
- ↑ a b c d Boland BB, Rhodes CJ, Grimsby JS (September 2017). The dynamic plasticity of insulin production in β-cells. Molecular Metabolism 6 (9): 958–973. PMID 28951821. PMC 5605729. DOI: 10.1016/j.molmet.2017.04.010.
- ↑ Wilcox G (May 2005). Insulin and insulin resistance. The Clinical Biochemist. Reviews 26 (2): 19–39. PMID 16278749. PMC 1204764.
- ↑ Westermark P, Andersson A, Westermark GT (July 2011). Islet amyloid polypeptide, islet amyloid, and diabetes mellitus. Physiological Reviews 91 (3): 795–826. PMID 21742788. DOI: 10.1152/physrev.00042.2009.
- ↑ Boland BB, Brown C, Alarcon C, Demozay D, Grimsby JS, Rhodes CJ (February 2018). β-Cell Control of Insulin Production During Starvation-Refeeding in Male Rats. Endocrinology 159 (2): 895–906. PMID 29244064. PMC 5776497. DOI: 10.1210/en.2017-03120.
- ↑ Andrali SS, Sampley ML, Vanderford NL, Ozcan S (October 2008). Glucose regulation of insulin gene expression in pancreatic beta-cells. The Biochemical Journal 415 (1): 1–10. PMID 18778246. DOI: 10.1042/BJ20081029.
- ↑ a b c d e Fu Z, Gilbert ER, Liu D (January 2013). Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes. Current Diabetes Reviews 9 (1): 25–53. PMID 22974359. PMC 3934755. DOI: 10.2174/157339913804143225.
- ↑ Omar-Hmeadi M.; Idevall-Hagren O. (2021). Insulin granule biogenesis and exocytosis. Cellular and Molecular Life Sciences (REVISIÓN) 78: 1957-1970. PMID 33146746. PMC 7966131. DOI: 10.1007/s00018-020-03688-4.
- ↑ Tokarz V.L.; MacDonald P.E.; Klip A. (2018). The cell biology of systemic insulin function. J Cell Biol. (REVISIÓN) (en inglés) 217 (7): 2273-2289. PMC 6028526. DOI: 10.1083/jcb.201802095.
- ↑ Huising M.O. (2020). Paracrine regulation of insulin secretion. Diabetologia (REVISIÓN) (en inglés) (Springer) 63 (10): 2057-2063. PMID 32894316. PMC 7968070. DOI: 10.1007/s00125-020-05213-5.