Alfacel
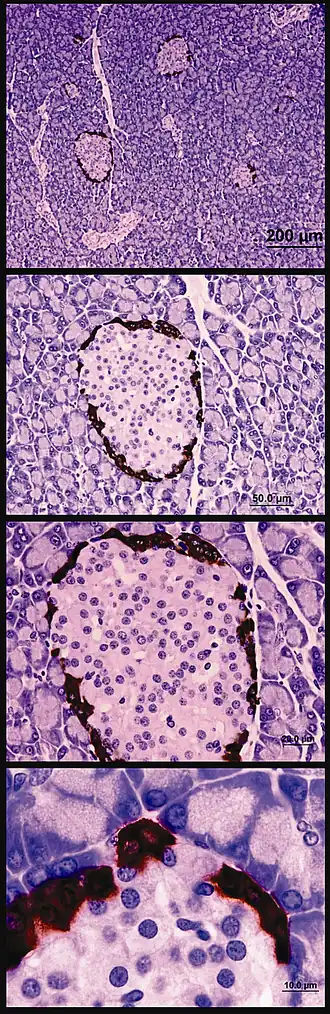

Alfacellen (α-cellen) zijn endocriene cellen die zich bevinden in de eilandjes van Langerhans in de alvleesklier. Alfacellen scheiden het peptidehormoon glucagon af om de bloedglucosespiegel te verhogen.[1]
Alfacellen, zoals alle cellen van de eilandjes van Langerhans, ontstaan in het endoderm. Hun ontwikkeling vereist de aanwezigheid van Arx en FoxA2 en een lage expressie van het Pax4-gen. Verder zijn Pax6, Nkx6.1, Nkx6.2 en MafB belangrijk voor de differentiatie van alfacellen.[2]
Anatomie
Alfacellen zijn ongeveer 10 μm groot[3] met een oppervlak van 60 μm2.[4] Ze slaan glucagon op granulen in secretoire vesikels die doorgaans onder een electronenmicroscoop een elektronendichte kern en een grijsachtige buitenrand hebben.[1] Als secretiecel heeft de alfacel een aanzienlijk golgicomplex en een groot aantal mitochondriën. De celkern vertoont compact heterochromatine aan de periferie en een geplooid celmembraan.
Aangenomen wordt dat alfacellen ongeveer 20% van de endocriene cellen in de alvleesklier uitmaken. Alfacellen worden meestal aangetroffen aan de dorsale zijde van de alvleesklier en zeer zelden aan de ventrale zijde.[1]
Functie
Alfacellen spelen een rol bij het handhaven van de bloedglucosespiegel. Alfacellen worden gestimuleerd om glucagon te produceren als reactie op hypoglykemie, adrenaline, aminozuren, andere hormonen en neurotransmitters.[5]
Glucagonsecretie en regulatie van de gluconeogenese
Glucagon geeft de lever het signaal om met de gluconeogenese te beginnen, wat de glucosespiegel in het bloed verhoogt.[5] Glucagon bindt zich aan de glucagonreceptoren op het celmembranen van hepatocyten (levercellen). Deze ligandbinding veroorzaakt de activering van adenylaatcyclase, wat leidt tot de vorming van cAMP response element-binding protein (cAMP).[6] Naarmate de intracellulaire concentratie van cAMP stijgt, wordt proteïnekinase A (PKA) geactiveerd en fosforyleert het de transcriptiefactor CREB-bindingseiwit (CREB). CREB induceert vervolgens de transcriptie van glucose-6-fosfatase en fosfo-enolpyruvaatcarboxylase (PEPCK). Deze enzymen verhogen de gluconeogenese. PKA fosforyleert ook fosfo-fructokinase 2 (PFK2)/fructose-2,6-difosfatase (FBPase2), waardoor PFK2 wordt geremd en FBPase2 wordt geactiveerd.[6] Deze remming verlaagt de intracellulaire niveaus van fructose-2,6-difosfaat en verhoogt de intracellulaire niveaus van fructose-6-fosfaat, wat de glycolytische activiteit verlaagt en de gluconeogene activiteit verhoogt.[6] PKA fosforyleert ook pyruvaatkinase, wat een verhoging van de intracellulaire niveaus van fructose-1,6-difosfaat veroorzaakt en de intracellulaire niveaus van pyruvaat verlaagt, waardoor de glycolytische activiteit verder afneemt.[6] De belangrijkste werking van PKA bij het reguleren van de gluconeogenese is de fosforylering van fosforylasekinase, wat de glycogenolysereactie initieert. Dit is de omzetting van glycogeen in glucose, door glycogeen om te zetten in glucose-1-fosfaat.[6]
Alfacellen genereren ook glucagon-achtig peptide 1 en kunnen een beschermend en regenererend effect hebben op bètacellen. Ze kunnen mogelijk transdifferentiëren naar bètacellen om verloren bètacellen te vervangen.[7]
Regulering van de glucagonsecretie
Er zijn verschillende methoden om de glucagonsecretie te reguleren. De meest bestudeerde methode is via de werking van extra-alvleesklierglucosesensoren, waaronder zenuwcellen in de hersenen en het ruggenmerg, die de alfacellen in de alvleesklier controleren. Ook indirecte, niet-neuronale controle blijkt de glucagonsecretie te beïnvloeden.[5]
Neuronale controle
Het meest bestudeert is de werking van extra-alvleesklierglucosesensoren, waaronder zenuwcellen in de hersenen, die controle uitoefenen over de alfacellen in de alvleesklier.[5] De alvleesklier wordt aangestuurd door zowel het sympathische als het parasympathische zenuwstelsel, hoewel de methode die deze twee systemen gebruiken om de alvleesklier aan te sturen, verschillend lijkt te zijn.[8]
De sympathische controle van de alvleesklier lijkt afkomstig te zijn van de sympathische preganglionaire zenuwvezels in het onderste thoracale en lumbale ruggenmerg.[9] In het autonome zenuwstelsel staan de zenuwvezels van het centrale zenuwstelsel naar het ganglion bekend als preganglionaire zenuwvezels. Volgens Travagli et al. "Axonen van deze neuronen verlaten het ruggenmerg via de ventrale wortels en voorzien ofwel de paravertebrale ganglia van de sympathische keten via de communicerende rami van de thoracale en lumbale zenuwen, ofwel de coeliakie- en mesenteriale ganglia via de nervi splanchnici. De sympathische ganglia, of paravertebrale ganglia, zijn autonome ganglia van het sympathische zenuwstelsel. De catecholaminezenuwcellen van deze ganglia innerveren de intra-alvleesklierganglia, eilandjes van Langerhans en bloedvaten..."[9] De exacte aard van het effect van sympathische activatie op de alvleesklier is moeilijk te achterhalen. Er zijn echter een paar dingen bekend. Het lijkt erop dat stimulatie van de nervi splanchnici de glucagonsecretie verhoogt. Beide bevindingen suggereren dat sympathische stimulatie van de alvleesklier bedoeld is om de bloedglucosespiegels te handhaven tijdens verhoogde opwinding.[9]
De parasympathische controle van de alvleesklier lijkt afkomstig te zijn van de nervus vagus.[8] Elektrische en farmacologische stimulatie van de nervus vagus verhoogt de secretie van glucagon en insuline bij de meeste zoogdiersoorten, waaronder de mens. Dit suggereert dat de rol van parasympathische controle is om een normale bloedglucoseconcentratie onder normale omstandigheden te handhaven.[8]
Niet-neuronale controle
Niet-neuronale controle blijkt indirecte paracriene regulatie te zijn via ionen, hormonen en neurotransmitters. Zink, insuline, serotonine, gamma-aminoboterzuur en 4-hydroxybutaanzuur, die allemaal worden afgegeven door bètacellen in de alvleesklier blijken de glucagonproductie in alfacellen te onderdrukken. Deltacellen geven ook somatostatine af, waarvan is aangetoond dat het de glucagonsecretie remt.[5]
Zink wordt gelijktijdig met insuline afgescheiden door de bètacellen in de alvleesklier. Er wordt verondersteld dat het als een paracrien signaal fungeert om de glucagonsecretie in alfacellen te remmen. Zink wordt in zowel alfa- als bètacellen getransporteerd door de zinktransporter ZnT8. Dit eiwitkanaal zorgt ervoor dat zink het celmembraan kan passeren en de cel in kan komen. Wanneer ZnT8 te weinig tot expressie komt, is er een duidelijke toename van de glucagonsecretie. Wanneer ZnT8 overmatig tot expressie komt, is er een duidelijke afname van de glucagonsecretie. Het exacte mechanisme waarmee zink de glucagonsecretie remt, is niet bekend.[10]
Insuline blijkt te functioneren als een paracrien signaal om de glucagonsecretie door de alfacellen te remmen.[11] Dit gebeurt echter niet via een directe interactie. Het lijkt erop dat insuline de glucagonsecretie remt door de activering van deltacellen om somatostatine af te scheiden.[12] Insuline bindt aan sodium/glucose cotransporter 2 (SGLT2), wat leidt tot een verhoogde glucoseopname in deltacellen. SGLT2 is een natrium- en glucosesymporter, wat betekent dat het glucose- en natriumionen tegelijkertijd in dezelfde richting door het membraan transporteert. Deze instroom van natriumionen kan, onder de juiste omstandigheden, een depolarisatiegebeurtenis over het membraan veroorzaken. Dit opent calciumkanalen, waardoor de intracellulaire calciumspiegel stijgt. Deze toename van de calciumconcentratie in het cytosol activeert ryanodinereceptoren op het endoplasmatisch reticulum, wat leidt tot de afgifte van meer calcium in het cytosol. Deze toename van calcium veroorzaakt de secretie van somatostatine door de deltacellen.[12]
Somatostatine remt de glucagonsecretie door activering van somatostatin receptor 2 (SSTR2), een membraangebonden eiwit dat bij activering een hyperpolarisatie van het membraan veroorzaakt. Deze hyperpolarisatie zorgt ervoor dat spanningsafhankelijke calciumkanalen sluiten, wat leidt tot een daling van de intracellulaire calciumspiegel. Dit leidt tot een afname van de exocytose. In het geval van alfacellen leidt dit tot een afname van de glucagonsecretie.[13]
Serotonine remt de glucagonsecretie via de receptoren op het celmembraan van alfacellen. Alfacellen hebben 5-HT1f-receptoren (5-hydroxytryptamine (serotonin) receptor 1F) die worden geactiveerd door de binding van serotonine. Eenmaal geactiveerd, onderdrukken deze receptoren de werking van adenylylcyclase, wat de productie van cAMP onderdrukt. De remming van de cAMP-productie onderdrukt op zijn beurt de glucagonsecretie.[5] Serotonine wordt beschouwd als een paracriene uitscheiding vanwege de nabijheid van bètacellen ten opzichte van alfacellen.[14]
Glucose kan ook een enigszins directe invloed hebben op de glucagonsecretie. Dit komt door de invloed van ATP. De cellulaire ATP-concentratie weerspiegelt direct de glucoseconcentratie in het bloed. Als de ATP-concentratie in alfacellen daalt, sluiten de kaliumionkanalen in het celmembraan. Dit veroorzaakt depolarisatie over het membraan, waardoor calciumionkanalen opengaan en calcium de cel kan binnenstromen. Deze toename van de cellulaire calciumconcentratie zorgt ervoor dat secretoire vesikels die glucagon bevatten, fuseren met het celmembraan, waardoor de alvleesklier glucagon afscheidt.[5]
Klinische betekenis
Een verstoorde alfacelfunctie is een belangrijke factor in de etiologie van pathologieën die verband houden met een ontregelde glucosehomeostase, zoals obesitas, Diabetes mellitusdiabetes type 2 en het syndroom van Cushing.[15]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Alpha cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b c (en) Islets of Langerhans. Springer Netherlands, Dordrecht. DOI:10.1007/978-94-007-6686-0 (2015). ISBN 978-94-007-6685-3.
- ↑ Wendt A.; Eliasson L. (2020). Pancreatic α-cells –The unsung heroes in islet function (Artículo de revisión). Seminars in Cell & Developmental Biology (en inglés) 103. pp. 41-50. Consultado el 9 de setiembre de 2022.
- ↑ Gao R, Acreman S, Ma J, Abdulkader F, Wendt A, Zhang Q. (26 juni 2023). α-cell electrophysiology and the regulation of glucagon secretion. J Endocrinol 258 (2): e220295. PMID 37159865. PMC 10326640. DOI: 10.1530/JOE-22-0295.
- ↑ Eva Bru Tari, Nadia Cobo-Vuilleumier, Paloma Alonso-Magdalena, Miguel. einaldo Sousa dos SantosPancreatic alpha-cell mass in the early-onset and advanced stage of a mouse model of experimental autoimmune diabetes Springer Nature, Scientific Reports, July 2019 (1) DOI:10.1038/s41598-019-45853-1
- ↑ a b c d e f g (en) Yu, Qian, Shuai, Hongyan, Ahooghalandari, Parvin, Gylfe, Erik, Tengholm, Anders (July 2019). Glucose controls glucagon secretion by directly modulating cAMP in alpha cells. Diabetologia 62 (7): 1212–1224. ISSN: 0012-186X. PMID 30953108. PMC 6560012. DOI: 10.1007/s00125-019-4857-6.
- ↑ a b c (en) Janah, Lina, Kjeldsen, Sasha, Galsgaard, Katrine D., Winther-Sørensen, Marie, Stojanovska, Elena (January 2019). Glucagon Receptor Signaling and Glucagon Resistance. International Journal of Molecular Sciences 20 (13): 3314. ISSN: 1422-0067. PMID 31284506. PMC 6651628. DOI: 10.3390/ijms20133314.
- ↑ Stanojevic, Violeta, Habener, Joel F. (8 oktober 2015). Evolving Function and Potential of Pancreatic Alpha Cells. Best Practice & Research. Clinical Endocrinology & Metabolism 29 (6): 859–871. ISSN: 1521-690X. PMID 26696515. PMC 4690008. DOI: 10.1016/j.beem.2015.10.002.
- ↑ a b (en) Verberne, Anthony J. M., Mussa, Bashair M. (1 juni 2022). Neural control of pancreatic peptide hormone secretion. Peptides 152: 170768. ISSN: 0196-9781. PMID 35189258. DOI: 10.1016/j.peptides.2022.170768.
- ↑ a b c (en) Babic, Tanja, Travagli, R. Alberto (23 september 2016). Neural Control of the Pancreas. Pancreapedia: The Exocrine Pancreas Knowledge Base. DOI: 10.3998/panc.2016.27.
- ↑ (en) Rutter, Guy A., Chabosseau, Pauline, Bellomo, Elisa A., Maret, Wolfgang, Mitchell, Ryan K. (February 2016). Intracellular zinc in insulin secretion and action: a determinant of diabetes risk?. Proceedings of the Nutrition Society 75 (1): 61–72. ISSN: 0029-6651. PMID 26365743. DOI: 10.1017/S0029665115003237.
- ↑ (en) Asplin, C. M., Paquette, T. L., Palmer, J. P. (1 juli 1981). In vivo inhibition of glucagon secretion by paracrine beta cell activity in man.. The Journal of Clinical Investigation 68 (1): 314–318. ISSN: 0021-9738. PMID 7019246. PMC 370801. DOI: 10.1172/JCI110251.
- ↑ a b (en) Vergari, Elisa, Knudsen, Jakob G., Ramracheya, Reshma, Salehi, Albert, Zhang, Quan (11 januari 2019). Insulin inhibits glucagon release by SGLT2-induced stimulation of somatostatin secretion. Nature Communications 10 (1): 139. ISSN: 2041-1723. PMID 30635569. PMC 6329806. DOI: 10.1038/s41467-018-08193-8.
- ↑ (en) Kailey, Balrik, van de Bunt, Martijn, Cheley, Stephen, Johnson, Paul R., MacDonald, Patrick E. (1 november 2012). SSTR2 is the functionally dominant somatostatin receptor in human pancreatic β- and α-cells. American Journal of Physiology. Endocrinology and Metabolism 303 (9): E1107–E1116. ISSN: 0193-1849. PMID 22932785. PMC 3492856. DOI: 10.1152/ajpendo.00207.2012.
- ↑ (en) Almaça, Joana, Molina, Judith, Menegaz, Danusa, Pronin, Alexey N., Tamayo, Alejandro (20 december 2016). Human Beta Cells Produce and Release Serotonin to Inhibit Glucagon Secretion from Alpha Cells. Cell Reports 17 (12): 3281–3291. ISSN: 2211-1247. PMID 28009296. PMC 5217294. DOI: 10.1016/j.celrep.2016.11.072.
- ↑ Rafacho A.; Gonçalves-Neto L.M.; Santos-Silva J.C.; Alonso-Magdalena P.; Merino B.; Taboga S.R.; Quesada I.; Carneiro E.M.; Boschero A.C.; Nadal A. (2014). «Pancreatic Alpha-Cell Dysfunction Contributes to the Disruption of Glucose Homeostasis and Compensatory Insulin Hypersecretion in Glucocorticoid-Treated Rats.». PLoS ONE (en inglés) 9 (4): e93531. doi:10.1371/journal.pone.0093531. Consultado el 8 de setiembre de 2022.