Folliculostellaatcel
_isolated_FC_cell%253B_(b)_a_group_of_FS_cells%253B_(c)_diffuse_network_of_FS_cells%253B_(d)_FS_cells_forming_a_follicle.png)
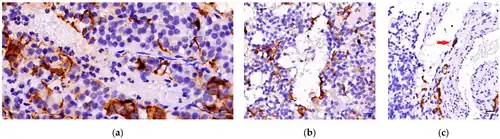

Een folliculostellaatcel is een type niet-endocriene cel die zich in de voorste kwab van de hypofyse bevindt.[1]
Histologie en structuur
Rinehart en Farquhar ontdekten folliculostellaatcellen voor het eerst via elektronenmicroscopie van de hypofyse. Vila-Porcile noemde deze niet-endocriene cellen in 1972 "folliculo-stellate" cellen vanwege hun stervorm en hun ligging aan de binnenkant van het lumen van kleine follikels in de hypofyse.[1] In tegenstelling tot de meeste cellen in de hypofyse zijn ze niet-endocrien en hebben geen cytoplasmatische granulen (korrels).[2] Ze hebben lange cytoplasmatische uitlopers die in elkaar grijpen en een netwerk vormen, waarin de endocriene cellen zich bevinden.[2] Ze hebben doorgaans een groot aantal microvilli aan hun apicale zijde en bevatten lysosomen, wat wijst op fagocytische activiteit.[3] Gap junctions zijn zichtbaar tussen de folliculostellaatcellen en de aangrenzende endocriene cellen wanneer ze onder een elektronenmicroscoop worden bekeken.[3]
Transmissie-elektronenmicroscopisch onderzoek heeft aangetoond dat de follikels omgeven door folliculostellaatcellen een apicaal junctioneel complex hebben op de cel-cel-interfaces van folliculostellaatcellen bij verschillende soorten, zoals de mens en ratten. Het apicale junctionele complex wordt aangetroffen in de meeste epitheelceltypen en bestaat uit zonula occludens, zonula adhaerens en desmosomen. Zonula adhaerens en desmosomen dragen bij aan de mechanische sterkte en weefselintegriteit van het epitheel en zonula occludens zijn verantwoordelijk voor het behoud van de epitheliale barrièrefunctie. In zonula adhaerens vormen transmembraaneiwit-cadherinen een intercellulaire brug door het extracellulaire domein en maken ze een mechanische verbinding met het cytoskelet met de intracellulaire staart via de cytoplasmatische plaque-eiwitten α- en β-catenine.[4]
Celeigenschappen
Met behulp van hypofyse-plakjes zijn studies uitgevoerd die hebben aangetoond dat folliculostellaatcellen zijn gerangschikt in 3D-netwerken die intracellulair kunnen communiceren via gap junction-gemedieerde calciumgolfvoortplanting.[5] Experimenten met twee belangrijke folliculostellaatcellijnen (TtT/GF en Tpit/F1) hebben onze kennis over de functionele relevantie van deze cellen enorm verbeterd. Het is aangetoond dat folliculostellaatcellen een rol spelen op drie gebieden van het gebruik van de hypofyse: autocriene (op de producerende cel zelf)/paracriene controle van de functie van de hypofysecellen door middel van cytokines en groeifactoren, intrahypofysecommunicatie tussen verschillende celtypen en modulatie van de terugkoppeling van de ontstekingsreactie.[5]
Folliculostellaatcellen hebben vergelijkbare eigenschappen als dendritische cellen en macrofagen, wat duidt op een fagocytaire rol.[3] Dat folliculostellaatcellen een hoofdrol spelen bij het modereren van de neuro-immuun/endocriene regulatie van ontstekingen, wordt ondersteund door gegevens in combinatie met het afbeelden van C3a- en C5a-receptoren (de belangrijkste factoren van het aangeboren immuunsysteem), het afscheiden van IL-6 en MIF (macrofagen-migratie-inhibitiefactor, is een ontstekingscytokine) en het reguleren van de afgifte van deze cytokinen via ontstekingsremmende moleculen.[5] Er zijn experimenten uitgevoerd om de eiwitmarkers die ze tot expressie brengen te beoordelen, om hun celtype en dus de exacte functie in de hypofyse te bepalen. Het eerste markereiwit dat in folliculostellaatcellen werd ontdekt, was S-100b, een calciumbindend eiwit dat tot expressie wordt gebracht door gliacellen. Sommige populaties folliculostellaatcellen blijken ook verschillende celmarkers tot expressie te brengen, waaronder GFAP (Glial fibrillary acidic protein), cytokeratine, vimentine en fibronectine.[2] De expressie van het S-100-eiwit en GFAP lijkt het sterkst te zijn in vroege, nieuw gevormde folliculostellaatcellen en zou dus belangrijk kunnen zijn bij de vroege ontwikkeling van deze cellen.[6] De GFAP-expressie impliceert dat deze cellen van neuro-ectodermale oorsprong zouden kunnen zijn,[7] terwijl keratine-positieve folliculostellaatcellen epitheelachtige kenmerken vertonen.[8] Het onderzoek naar de expressie van fibronectine in deze cellen suggereert dat folliculostellaatcellen kunnen helpen bij het reguleren van de hypofysefunctie door interactie met hormoonafscheidende cellen via fibronectine.[9] Bovendien ondersteunt het feit dat folliculostellaatcellen vimentine tot expressie brengen, een intermediaire filamentproteïnemarker, de theorie dat folliculostellaatcellen afkomstig kunnen zijn van gliale neuro-ectodermcellen.[10]
Vanwege de verschillende reeksen markers die in deze cellen tot expressie komen, is het moeilijk om hun exacte celtype en functie te specificeren. Nieuwere bevindingen suggereren dat hypofyse-folliculostellaatcellen bestaan uit groepen cellen met uiteenlopende immunofenotypen en geen homogene populatie vormen; het is echter nog steeds niet duidelijk of deze groepen cellen daadwerkelijk verschillend zijn of gewoon cellen in verschillende stadia van hun ontwikkeling zijn.[5] Er zijn meerdere folliculostellaatcellijnen ontwikkeld om te proberen de locatie en functie van deze cellen te observeren. De mRNA-niveaus van folliculostellaatcellen zijn onderzocht via laser capture microdissectie en RT-PCR (reverse-transcriptie-PCR), dus er wordt vooruitgang geboekt in het begrijpen van de expressie en functie van deze niet-endocriene cellen van de hypofyse.[2] Omdat ze meerdere markers hebben, is het aannemelijk dat deze cellen een hybride zijn van verschillende celtypen.
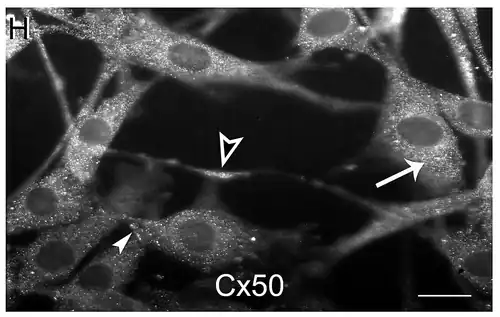
Gap junctions tussen endocriene cellen en folliculostellaatcellen
Hoewel folliculostellaatcellen geen hormonen afscheiden, beïnvloeden ze de functionaliteit van hormoonafscheidende endocriene cellen via gap junctions. Folliculostellaatcellen vormen homologe gap junctions met hun aangrenzende tegenhangers, maar ook heterologe gap junctions met hormoonafscheidende endocriene cellen.[11] De gap junctions tussen aangrenzende folliculostellaatcellen worden gebruikt om calcium-gemedieerde signalen door de hypofyse te verspreiden om de functie van exciteerbare endocriene cellen, verspreid over de klier, te coördineren. De gap junctions tussen endocriene en folliculostellaatcellen vormen, samen met de folliculostellaatcel-folliculostellaatcel gap junctions, een celnetwerk dat informatie over de fysiologische omgeving door de hypofyse heen kan transporteren om de secretoire functie ervan te coördineren.[12]
Studies bij verschillende kleine zoogdieren hebben aangetoond dat het aantal gap junctions wordt beïnvloed door verschillende factoren, zoals de puberteit, de menstruatiecyclus en de lactatie. Bij nertsen correleert de aanwezigheid van het connexine-43-eiwit, dat functioneel is in gap junctions, met de vraag naar prolactinesecretie, afhankelijk van het broedseizoen. Wanneer de prolactinesecretie het hoogst is in de lente, is er de grootste overvloed aan connexine-43 gap junctions; prolactinesecretie en gap junctions zijn het laagst in de winter.[1]

Dit toont aan dat het folliculostellaatcelnetwerk een rol speelt bij het beïnvloeden van de prolactinesecretie. Dit komt overeen met studies bij ratten waaruit bleek dat gap junctions toenamen tijdens de lactatie om de prolactinevraag te vergemakkelijken.[3] Aanvullende studies bij ratten lieten zien dat het aantal gap junctions toenam met de rijping van de adenohypofyse. Deze toename werd voorkomen door castratie bij mannelijke ratten, wat seksuele rijping zou voorkomen en werd hersteld tot normale waarden door hormoonbehandeling. Evenzo nemen gap junctions toe tijdens de pro-oestrus- en oestrusfasen van de oestruscyclus en nemen ze met vijftig procent af tijdens de di-oestrusfase.[3] Oestrus is de cyclus van veranderingen in de genitale organen, veroorzaakt door de hormonale werking van ovariële follikels. Blijkbaar wordt het aantal gap junctions beïnvloed door de secretie van steroïde hormonen vanuit de gonaden en dragen folliculostellaatcellen bij aan de feedbackloop tussen de hypofyse en de gonaden.
Functies als ondersteunende cellen
Folliculostellaatcellen worden verondersteld een ondersteunende functie te hebben vanwege hun positie naast de endocriene (hormoonafscheidende) cellen van de hypofyse. Dit impliceert een mechanische of chemische ondersteuning – door structurele ondersteuning te vormen rond de endocriene cellen of door groeifactoren en cytokinen (celsignaleringsmoleculen) af te geven.[1] Structurele ondersteuning wordt geïllustreerd doordat folliculostellaatcellen bekend staan om de productie van een metalloproteaseremmer, die het basaal membraan kan beschermen en de driedimensionale structurele ondersteuning kan behouden; en door endocriene cellen te omringen en nauw contact te maken om de hypofyse te voorzien van de groeifactoren en cytokinen.[13]
Rol als signaalmediatoren voor endocriene cellen in de hypofyse
Stikstofmonoxide
Folliculostellaatcellen spelen vermoedelijk een rol bij het doorgeven van signalen aan de hormoonproducerende endocriene cellen van de hypofyse. Stikstofmonoxide (NO) zou een belangrijke modulator zijn van de endocriene celfunctie. Het is aangetoond dat folliculostellaatcellen (en sommige endocriene cellen) neuronale NO-synthase bevatten, een belangrijk enzym dat NO produceert[3] en verantwoordelijk is voor de productie van NO uit L-arginine.[14] Alle α-aminozuren (behalve glycine) hebben een asymmetrisch koolstofatoom (chiraal koolstofatoom). Dit betekent dat deze aminozuren in twee vormen (isomeren) kunnen voorkomen, de L-vorm en de D-vorm — deze twee vormen zijn het spiegelbeeld van elkaar (zie optische isomerie). De natuurlijke aminozuren komen in de L-vorm voor.
Men denkt dat folliculostellaatcellen de NO-productie in aangrenzende endocriene cellen moduleren via paracriene mechanismen.
Interferon-gamma
Interferon-gamma is een cytokine dat de afgifte van verschillende hormonen uit de adenohypofyse remt.[15] Men denkt dat folliculostellaatcellen essentieel zijn bij het bemiddelen van dit proces.[16] Deze faciliterende rol van folliculostellaatcellen werd geïdentificeerd bij onderzoek van de hypofyseklieren van ratten, aangezien hypofysemonsters met weinig folliculostellaatcellen niet de gebruikelijke remmende effecten van interferon-gamma vertoonden.
Glucocorticoïden
De door glucocorticoïden geïnduceerde onderdrukking van de hypothalamus-hypofyse-bijnieras (HPA-as) bestaat uit twee componenten. Ten eerste is er binnen 15 minuten na blootstelling aan verhoogde glucocorticoïden in de adenohypofyse een afname in de afgifte van voorgevormd adrenocorticotroop hormoon (ACTH). Ten tweede werken glucocorticoïden op genomisch niveau door de translatie van ACTH en corticotropin-releasing hormone (CRH) te onderdrukken: dit proces duurt twee uur na blootstelling aan verhoogde glucocorticoïden.[3]
Het eiwit annexine A1 (ANXA1), dat in grote hoeveelheden in de adenohypofyse wordt aangetroffen, bevindt zich specifiek in de folliculostellaatcel.[1] Naast de adenohypofyse is het ook te vinden in de niet-endocriene cellen van de hypothalamus. Glucocorticoïden werken in op de folliculostellaatcellen om de synthese van annexine A1 te verhogen en stimuleren vervolgens de translocatie naar het celoppervlak van de folliculostellaatcel. Deze translocatie is afhankelijk van proteïnekinase C.[3] ANXA1 werkt vervolgens in op de corticotrofen van de adenohypofyse, die ANXA1 G-proteïnegekoppelde receptoren tot expressie brengen, via een paracrien mechanisme. De daaropvolgende signaalroute, die culmineert in een verminderde ACTH-synthese en/of -afgifte, is grotendeels onontgonnen en daardoor nog slecht begrepen.[3]
De relatie tussen glucocorticoïden en folliculostellaatcellen speelt ook een rol bij de productie van de stimulerende neurotransmitter glutamine. Cellen in de adenohypofyse van ratten die grote hoeveelheden van het enzym glutaminesynthetase bevatten, brengen ook het S100-eiwit tot expressie, de marker voor folliculostellaatcellen. Na toediening van exogene glucocorticoïden neemt het aantal van deze cellen toe en neemt ook de activiteit van glutaminesynthetase toe.[1] Dit enzym is noodzakelijk omdat het het centraal zenuwstelsel in staat stelt intern glutamine te produceren. Dit is essentieel omdat de hoeveelheid glutamine die vanuit het perifere bloed naar het centraal zenuwstelsel wordt getransporteerd niet kan voldoen aan de behoefte van het centraal zenuwstelsel aan glutamine.[17]
Interleukine-6
De productie van het cytokine interleukine-6 (IL-6) zou ook een ondersteunende functie kunnen hebben, aangezien IL-6 een bemiddelaar is in de communicatie tussen het endocriene en het immuunsysteem. De productie van IL-6 door folliculostellaatcellen induceert de hormoonproductie van endocriene cellen, die vervolgens het immuunsysteem kunnen activeren.[1]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Folliculostellate cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b c d e f (en) Devnath, S., Inoue, K. (1 juni 2008). An Insight to Pituitary Folliculo-Stellate Cells. Journal of Neuroendocrinology 20 (6): 687–691. ISSN: 1365-2826. PMID 18601690. DOI: 10.1111/j.1365-2826.2008.01716.x.
- ↑ a b c d (en) Fauquier, Teddy, Guérineau, Nathalie C., McKinney, R. Anne, Bauer, Karl, Mollard, Patrice (17 juli 2001). Folliculostellate cell network: A route for long-distance communication in the anterior pituitary. Proceedings of the National Academy of Sciences 98 (15): 8891–8896. ISSN: 0027-8424. PMID 11438713. PMC 37531. DOI: 10.1073/pnas.151339598.
- ↑ a b c d e f g h i Inoue, K., Couch, E. F., Takano, K., Ogawa, S. (August 1999). The structure and function of folliculo-stellate cells in the anterior pituitary gland. Archives of Histology and Cytology 62 (3): 205–218. ISSN: 0914-9465. PMID 10495875. DOI: 10.1679/aohc.62.205.
- ↑ Higashi, A.Y., Higashi, T., Furuse, K. et al. Claudin-9 constitutes tight junctions of folliculo-stellate cells in the anterior pituitary gland. Sci Rep 11, 21642 (2021). https://doi.org/10.1038/s41598-021-01004-z
- ↑ a b c d Rees, DA (7 november 2005). Folliculostellate cells: what are they?. Endocrine Abstracts 10. Geraadpleegd op 28 september 2017.
- ↑ Horvath, Eva, Kovacs, Kalman (1 januari 2002). Folliculo-stellate Cells of the Human Pituitary: A Type of Adult Stem Cell?. Ultrastructural Pathology 26 (4): 219–228. ISSN: 0191-3123. PMID 12227947. DOI: 10.1080/01913120290104476.
- ↑ Velasco, M. E., Roessmann, U., Gambetti, P. (March 1982). The presence of glial fibrillary acidic protein in the human pituitary gland. Journal of Neuropathology and Experimental Neurology 41 (2): 150–163. ISSN: 0022-3069. PMID 7062085. DOI: 10.1097/00005072-198203000-00005.
- ↑ Shimada, T. (February 1992). Immunohistochemical localization of keratin in bull, goat, and sheep anterior pituitary glands. Cell and Tissue Research 267 (2): 251–260. ISSN: 0302-766X. PMID 1376215. DOI: 10.1007/bf00302962.
- ↑ Liu, Y. C., Tanaka, S., Inoue, K., Kurosumi, K. (1989). Localization of fibronectin in the folliculo-stellate cells of the rat anterior pituitary by the double bridge peroxidase-antiperoxidase method. Histochemistry 92 (1): 43–45. ISSN: 0301-5564. PMID 2670846. DOI: 10.1007/bf00495014.
- ↑ Marin, F., Boya, J., Lopez-Carbonell, A. (1989). Immunocytochemical localization of vimentin in stellate cells (folliculo-stellate cells) of the rat, cat and rabbit pituitary pars distalis. Anatomy and Embryology 179 (5): 491–495. ISSN: 0340-2061. PMID 2471422. DOI: 10.1007/bf00319592.
- ↑ Morand, I., Fonlupt, P., Guerrier, A., Trouillas, J., Calle, A. (August 1996). Cell-to-cell communication in the anterior pituitary: evidence for gap junction-mediated exchanges between endocrine cells and folliculostellate cells. Endocrinology 137 (8): 3356–3367. ISSN: 0013-7227. PMID 8754762. DOI: 10.1210/endo.137.8.8754762.
- ↑ Fauquier, T., Guérineau, N. C., McKinney, R. A., Bauer, K., Mollard, P. (2001). Folliculostellate cell network: A route for long-distance communication in the anterior pituitary. PNAS 98 (15): 8891–8896. PMID 11438713. PMC 37531. DOI: 10.1073/pnas.151339598.
- ↑ Inoue, K., Mogi, C., Ogawa, S., Tomida, M., Miyai, S. (April 2002). Are folliculo-stellate cells in the anterior pituitary gland supportive cells or organ-specific stem cells?. Archives of Physiology and Biochemistry 110 (1–2): 50–53. ISSN: 1381-3455. PMID 11935400. DOI: 10.1076/apab.110.1.50.911.
- ↑ Knowles, R. G., Moncada, S. (1 maart 1994). Nitric oxide synthases in mammals. The Biochemical Journal 298 (2): 249–258. ISSN: 0264-6021. PMID 7510950. PMC 1137932. DOI: 10.1042/bj2980249.
- ↑ Vankelecom, H., Carmeliet, P., Heremans, H., Van Damme, J., Dijkmans, R. (June 1990). Interferon-gamma inhibits stimulated adrenocorticotropin, prolactin, and growth hormone secretion in normal rat anterior pituitary cell cultures. Endocrinology 126 (6): 2919–2926. ISSN: 0013-7227. PMID 2161739. DOI: 10.1210/endo-126-6-2919.
- ↑ Vankelecom, H., Andries, M., Billiau, A., Denef, C. (June 1992). Evidence that folliculo-stellate cells mediate the inhibitory effect of interferon-gamma on hormone secretion in rat anterior pituitary cell cultures. Endocrinology 130 (6): 3537–3546. ISSN: 0013-7227. PMID 1317788. DOI: 10.1210/endo.130.6.1317788.
- ↑ Albrecht, Jan (2007). Glutamine in the central nervous system: function and dysfunction. Frontiers in Bioscience 12 (1): 332–43. PMID 17127302. DOI: 10.2741/2067.