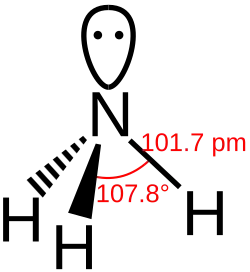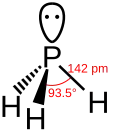Stikstofgroep
| Chemische groepen |
|---|
| Alkalimetalen (1) |
| Aardalkalimetalen (2) |
| Scandiumgroep (3) |
| Titaangroep (4) |
| Vanadiumgroep (5) |
| Chroomgroep (6) |
| Mangaangroep (7) |
| IJzergroep (8) |
| Kobaltgroep (9) |
| Nikkelgroep (10) |
| Kopergroep (11) |
| Zinkgroep (12) |
| Boorgroep (13) |
| Koolstofgroep (14) |
| (15) |
| Zuurstofgroep (16) |
| Halogenen (17) |
| Edelgassen (18) |
| Portaal |
Elementen van de stikstofgroep met IUPAC-groepsnummer 15, vroeger bekend als Va, uit het periodiek systeem zijn ook bekend als pnicogenen of pnictogenen, maar tegenwoordig wordt vooral de IUPAC-naam stikstofgroep gebruikt. Binaire verbindingen met een pnictogeen als anion worden collectief pnictiden genoemd.
Deze elementen kenmerken zich doordat er in de buitenste p-subschil drie elektronen voorkomen. De stikstofgroep is de enige groep in het periodiek systeem waarbij de overgangen van metaal naar niet-metaal en van zuurvormend en basevormend zo duidelijk naar voren komt. Het lichtste element uit deze groep, stikstof, is een niet-metaal en een matig sterke oxidator in reacties met metalen. Met bijvoorbeeld magnesium vormt het een nitride. Aan het andere uiterste van de stikstofgroep is bismut te vinden. Dat is een element dat duidelijk een metaal is.
Stikstof en fosfor zijn biologisch van groot belang omdat ze deel uitmaken van eiwitten en nucleïnezuren.
De elementen in de stikstofgroep zijn in het periodiek systeem hieronder gekleurd.
| 1 Ia |
18 0 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 H |
2 IIa |
Periodiek systeem | 13 IIIa |
14 IVa |
16 VIa |
17 VIIa |
2 He | ||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 3 | 11 Na |
12 Mg |
3 IIIb |
4 IVb |
5 Vb |
6 VIb |
7 VIIb |
8 VIIIb |
9 VIIIb |
10 VIIIb |
11 Ib |
12 IIb |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
↓ | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
↓↓ | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| Lanthanoïden | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||
| Actinoïden | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|||
| Chemische reeksen van het periodiek systeem | ||||||||||||||||||
| Alkalimetalen | Aardalkalimetalen | Overgangsmetalen | Hoofdgroepmetalen | Metalloïden | ||||||||||||||
| Niet-metalen | Halogenen | Edelgassen | Lanthanoïden | Actinoïden | ||||||||||||||
Hydriden
In de hydriden van de elementen uit de stikstofgroep komt enerzijds duidelijk de aparte positie van stikstof in de rij tot uiting, anderzijds ook gaande door de groep de trend in de fysische eigenschappen van de verbindingen.
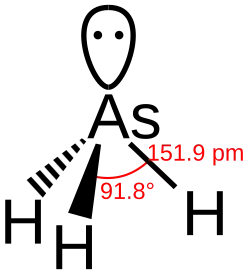
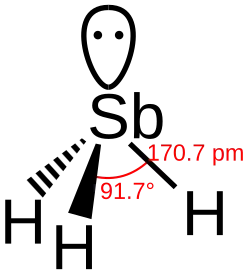
- De bindingslengte tussen waterstof en het centrale atoom van de verbinding neemt gestaag toe. De toename is toe te schrijven aan het steeds grotere atoomvolume. Er moet steeds een elektronenschil bij. De kleine toename tussen stibine en bismutine is een goed voorbeeld van de lanthanoïdencontractie.
- Er kan uit de bindingshoeken H - E - H meer worden afgeleid:
- Het stikstofatoom heeft in ammoniak een sp3-hybridisatie met bindingshoeken die nauwelijks afwijken van de voor een regelmatig viervlak gebruikelijke waarde van 109°.
- De overige vier verbindingen vertonen hoeken die erg dicht in de buurt liggen van de 90°, een indicatie voor vrijwel niet-gehybridiseerde p-orbitalen. Het gevolg is ook een nauwelijks gehybridiseerde s-orbitaal en een daarmee samenhangende bolvormige verdeling van de s-elektronen rond arseen. De structuren in de plaatjes voor deze verbindingen met het duidelijk omhoog stekende vrije elektronenpaar zijn dan ook eerder een artists impression dan een getrouwe weergave van de werkelijkheid voor deze elektronen.