Pterine
| Pterine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
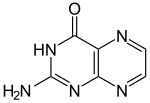
Structuurformule van pterine
| ||||
![Nummering in het pterine-systeem[1]](./Pteridin_-_Pteridine_Numbering.svg.png)
| ||||
Nummering in het pterine-systeem[1]
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | 2-Aminopteridin-4(3H)-one (een van de mogelijke tauyomeren; zie tekst) | |||
| Andere namen | Pteridoxamine Pterine 4-Oxopterine 2-Amino-4-pteridon 2-Amino-4-hydroxypteridine 2-Amino-4-oxopteridine 2-aminopteridin-4-ol 2-Amino-4-pteridinol | |||
| Molmassa | 163,137 g/mol | |||
| SMILES | O=C2\N=C(/Nc1nccnc12)N
| |||
| CAS-nummer | 2236-60-4 | |||
| PubChem | 73000 | |||
| Wikidata | Q386702 | |||
| ||||
_male.jpg)
De vleugels van het Oranjetipje danken hun kleur aan oranje gekleurde pterine-pigmenten en gaven hun naam aan deze groep verbindingen.[2]
Pterine is een heterocyclische verbinding bestaande uit een pteridine-systeem waaraan op positie 4 een keto- gekoppeld is en op plek 2 een amino-groep.De plaats naast een stikstof-atoom van het keton maakt pterine tot een cyclisch amide, een lactam. Pterines zijn verbindingen waarin deze basisstructuur terugkomt, maar aangevuld met extra substituenten. Hoewel pterines wijdverbreid in de natuur voorkomen is pterine zelf biologisch gezien niet relevant.
Pterines zijn voor het eerst aangetroffen in vlindervleugels,[2] waar de verbindingen ook hun naam aan danken: afgeleid uit het Grieks: πτερόν (pteron) dat "vleugel" betekent. Pterines spelen in veel biogene kleuren een rol.
Chemie
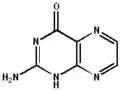
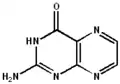
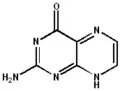
De structuur van pterines maakt een breed scala aan tautomeren mogelijk. Niet alleen behoort keto-enoltautomerie tot de mogelijkheden, voor de niet gesubstitueerde verbinding kunnen in water minstens 5 verschillende mogelijke structuren beschreven worden, die ook allemaal kunnen optreden.[3]Voor 6-methylpterine zijn zelfs 7 verschillende tautomeren voorspeld, die bovendien ook allemaal in waterige oplossingen een rol kunnen spelen.[4] Zoals de namen onder de verschillende tautomeren aangeven, kan elk ervan ook met een eigen systematische naam benoemd worden. De verschillen beperken zich tot de verdeling van de waterstof-atomen over de verschillende stikstof- en het zuurstof-atoom. De verschillende, met elkaar in evenwicht verkerende, vormen maken ook duidelijk dat het pterine-systeem tot een groot aantal verschillende reacties in staat is.
|
|
|
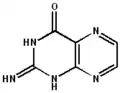
|
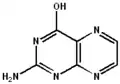
|
| 2-aminopteridin-4(1H)-on | 2-aminopteridin-4(3H)-on | 2-aminopteridin-4(8H)-on | 2-imino-2,3-dihydropteridin-4(1H)-on | 2-aminopteridin-4-ol |
De vier stikstof-atomen in het ringsysteem maken het vatbaar voor nucleofiele addities. Ook komen geheel of gedeeltelijk verzadigde verbindingen, de 7- en 8-plaats dragen een waterstof-atoom (voor die verbinding het meest stabiele tautomeer) of de plaatsen 5, 6, 7 en 8 dragen allemaal een extra waterstof-atoom. Deze groepen verbindingen komen veel voor in biologische systemen.[5]
Biosynthese
Het ringsysteem van pterines wordt biologisch gezien ofwel "gerecycled" op basis van een toevallig aanwezig pterine ofwel de novo opgebouwd. Uitgangsstof is in het laatste geval zowel bij bacteriën[6] als de mens GTP.[7]
Pterine-cofactoren
Pterine-derivaten zijn veel voorkomende cofactoren in alle gebieden van de biologie.
Folaten
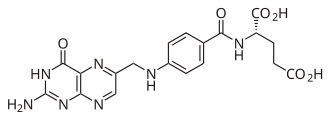
Foliumzuur
Een belangrijke groep pterine-derivaten wordt gevormd door de folaten. Dit zijn pterines die op positie 6 via een methylgroep gekoppeld zijn aan de aminogroep van 4-aminobenzoëzuur. Het aminobenzoëzuur is op zijn beurt tot amide omgezet met een of meer L-glutamaat-eenheden.
Folaten zijn betrokken bij een groot aantal groep-overdracht reacties waaronder
- de overdracht van methylgroepen van 5-methyltetrahydrofolaat naar homocysteïne waarbij L-methionine gevormd wordt
- de overdracht van formyl-groepen (-CHO) van 10-formyltetrahydrofolate naar L-methionine waarbij N-formylmethionine ontstaat, het eerste aminozuur dat tijdens de translatie als initiator dient voor de te vormen peptide-keten.
- de biosynthese van de purines en een pyrimidine is afhankelijk van folaten.
Gesubstitueerde pteridines zijn in veel micro-organismen betrokken in de biosynthese van dihydrofoliumzuur, de extra waterstof-atomen bevinden zich op de posities 7 en 8 van het pterine-systeem.[8]
Het enzym dihydropteroaat synthetase zet 4-aminobenzoëzuur in aanwezigheid van glutamaat om in dihydrofoliumzuur. Dit enzym wordt geremd door sulfonamide antibiotica.
Molybdopterine
Molybdopterine is een cofactor die voorkomt in bijna alle molybdeen-bevattende en alle wolfraam houdende enzymen.[6] Molybdopterine bindt een van de twee metalen, het complex is vervolgens betrokken bij de enzymatische hydroxylering, nitraat-reductie en de oxidatie in de ademhalingsreacties.[9]
In tegenstelling tot andere pterines wordt molybdopterine niet opgebouwd uit bestaande pterines, maar de nove vanuit GTP gesynthetiseerd.
Tetrahydrobiopterine
Tetrahydrobiopterine het voornaamste, vrij voorkomende, ptetine in gewervelden is betrokken bij drie groepen hydroxylasen voor aromatische aminozuren: fenylalanine-hydroxylase, tyrosine-hydroxylase en tryptofaan-hydroxylases. Deze enzymen spelen een rol in de synthese van de neurotransmitters catecholamine en serotonine. Tetrahydrobiopterine is ook noodzakelijk voor het functioneren van alkylglycerol-monooxygenase, dat monoalkylglycerolen afbreekt tot glycerol en een aldehyde. De synthese van Stikstofmonoxide wordt verzorgd door het van pterine afhankelijke enzym stikstofoxide synthase dat arginine omzet in het N-hydroxy-derivaat, wat op zijn beurt stikstofmonoxide afgeeft.[10]
Andere pterines
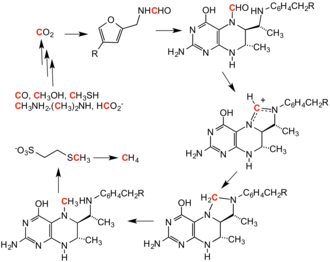
Tetrahydromethanopterine is een cofactor in de methanogenese, een reactieroute die door veel organismen als anaerobe ademhaling wordt gebruikt.[11] Het koolstof-atoom dat uiteindelijk als methaan wordt uitgescheiden is een groot deel van de syntheseroute aan een pterine gekoppeld. De structuur vannhet betreffende pterine lijkt erg op die van folaat.
Pterine pigmenten
Cyanopterine is een geglycosyleerd pterine-derivaat met een (juni 2025) onbekende functie in blauwalgen.[12]
See also
- Foliumzuur
- Molybdopterine
- Pteridine
- Tetrahydrobiopterine
- Tetrahydromethanopterine
Bron
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Pterin op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Verwijzingen in de tekst
- ↑ Handbook of Chemistry and Physics, first student edition, pag. C592, Uitg. CRC-press (1988) ISBN 0-8493-0740-6.
- ↑ a b Wijnen B, Leertouwer HL, Stavenga DG (December 2007). Colors and pterin pigmentation of pierid butterfly wings. Journal of Insect Physiology 53 (12), pag.: 1206–1217. PMID: 17669418. DOI: 10.1016/j.jinsphys.2007.06.016.
- ↑ Spyrakis F, Dellafiora L, Da C, Kellogg GE, Cozzini P (2013). Correct protonation states and relevant waters = better computational simulations?. Current Pharmaceutical Design 19 (23), pag.: 4291–4309. PMID: 23170888. DOI: 10.2174/1381612811319230011.
- ↑ Nekkanti S, Martin CB (1 March 2015). Theoretical study on the relative energies of cationic pterin tautomers. Pteridines 26 (1), pag.: 13–22. DOI: 10.1515/pterid-2014-0011.
- ↑ Basu P, Burgmayer SJ (May 2011). Pterin chemistry and its relationship to the molybdenum cofactor. Coordination Chemistry Reviews 255 (9–10), pag.: 1016–1038. PMID: 21607119. PMC: 3098623. DOI: 10.1016/j.ccr.2011.02.010.
- ↑ a b Feirer N, Fuqua C (1 May 2017). Pterin function in bacteria. Pteridines 28 (1), pag.: 23–36. DOI: 10.1515/pterid-2016-0012.
- ↑ Werner ER, Blau N, Thöny B (September 2011). Tetrahydrobiopterin: biochemistry and pathophysiology. The Biochemical Journal 438 (3), pag.: 397–414. PMID: 21867484. DOI: 10.1042/BJ20110293.
- ↑ Voet D, Voet JG (2004). Biochemistry (John Wiley & Sons).. ISBN 0-471-39223-5.
- ↑ Schwarz G, Mendel RR, Ribbe MW (August 2009). Molybdenum cofactors, enzymes and pathways. Nature 460 (7257), pag.: 839–847. PMID: 19675644. DOI: 10.1038/nature08302.
- ↑ (en) Werner ER (1 januari 2013). Three classes of tetrahydrobiopterin-dependent enzymes. Pteridines 24 (1), pag.: 7–11. ISSN: 2195-4720. DOI: 10.1515/pterid-2013-0003.
- ↑ Thauer RK (September 1998). Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture. Microbiology 144 (9), pag.: 2377–2406. PMID: 9782487. DOI: 10.1099/00221287-144-9-2377.
- ↑ Lee HW, Oh CH, Geyer A, Pfleiderer W, Park YS (January 1999). Characterization of a novel unconjugated pteridine glycoside, cyanopterin, in Synechocystis sp. PCC 6803. Biochimica et Biophysica Acta (BBA) - Bioenergetics 1410 (1), pag.: 61–70. PMID: 10076015. DOI: 10.1016/S0005-2728(98)00175-3.
Externe links
- Photochemistry and Reactivity of Pteridines Research Group. Universidad Nacional De La Plata. Gearchiveerd op 2 december 2013.