Molybdopterine
| Molybdopterine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
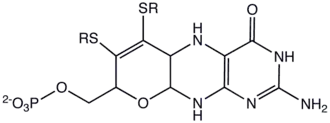
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | =[2-amino-4-oxo-6,7-bis(sulfanyl)-3,5,5~{a},8,9~{a},10-hexahydropyrano[3,2-g]pteridin-8-yl]methyl dihydrogen phosphate[1] | |||
| Molmassa | 394,33 g/mol (R = H, zie formule) | |||
| SMILES | NC(=N1)NC(=O)C2=C1N[C@H]3[C@@H](N2)C(S)=C(S)[C@H](O3)COP([O-])([O-])=O
| |||
| CAS-nummer | 73508-07-3 | |||
| PubChem | 135402014 | |||
| Wikidata | Q619698 | |||
| ||||
Molybdopterines vormen een groep van cofactoren voor de meeste molybdeen- en alle (juni 2025) bekende wolfraam-houdende enzymen. Synoniemen voor deze verbinding zijn: MPT en pyranopterin-dithiolate. Molybdopterine is een noodzakelijke stof voor alle (bekende) vormen van leven.[2]
Naam
De naam van de verbinding heeft de betekenis: molybdeen houdend pterine. Bij afkorten hoort het streepje dus voor de "p": molybdo-pterine. Ook op de uitspraak heeft dat effect: de "o" voor de "p" is een open lettergreep, de "pt"-combinatie is het begin van de volgende lettergreep.
De naamgeving van deze verbinding kan verwaarend zijn: molybdopterine bevat zelf geen molybdeen; het is de naam voor de ligand, een pterine, die uiteindelijk met molybdeen of wolfraam de biologisch actieve verbinding vormt. Met molybdeen wordt deze laatste molybdeen-cofactor (MOCO) genoemd.
Structuur
Molybdopterine bestaat een pterine (de twee rechter ringen in de structuurformule) en een daaraan gekoppelde pyraan-ring (de linker ring). De pyraanring draagt de twee zwavel-atomen die de binding tussen de ligand en de matalen verzorgen in de molybdo en wolframo-enzymen. In een aantal molbdipterines uis de fosfaatgroep uitgebreid tot een difosfaat-nucleotide.
Voorkomen
Enzymen waarin deze cofactor een rol speelt zij onder andere xanthineoxidase, DMSO-reductase, sulfietoxidase en nitraatreductase. het enige molybdeenhoudende enzym zonder molybdopterine is een nitrogenase (stikstof-bindend enzym) waarin een voornamelijk ijzer-zwavelcluster, met ook een molybdeen-atoom, het katalytische centrum is.[3]
Biosynthese

In tegenstelling tot veel andere cofactoren kan MOCO niet via het voedsel worden opgenomen. De verbinding moet dus de novo gesynthetiseerd worden. De synthese verloopt in vier stappen.
- Een via een radicaal verlopende cyclisering van guanosinetrifosfaat (GTP) tot (8S)‑3',8‐cyclo‑7,8‑dihydroguanosine 5'‑triphosphaat (3',8-cH2GTP).
- De vorming van cyclisch pyranopterino monofosfaat (cPMP) from the 3',8‑cH2GTP
- De omzetting van cPMP naar (MPT)
- Het inbouwen van molybdaat waarbij MOCO ontstaat.[4][5]
Twee enzymgestuurde reacties zetten guanosinetrifosfaat om in het cyclische fosfaat van pyranopterine. Een van deze enzymen is een radicaal SAM, een familie van enzymen die vaak geassocieerd wordt met bindingvormende reacties van koolstof naar zwavel en stikstof.[6][5][4] Dit tussenproduct, pyranopterine, wordt vervolgens door de werking van drie andere enzymen omgezet in molybdopterine. Bij deze omzetting wordt het eendithiolaat gevormd, hoewel de substituenten op zwavel onbekend blijven. Zwavel is afkomstig uit cysteïnylpersulfide op een manier die lijkt op de biosynthese van ijzer-zwavel-eiwitten . Het monofosfaat wordt geadenyleerd (gekoppeld aan ADP) in een stap die de cofactor activeert om Mo of W te kunnen binden. Deze metalen worden opgenomen als hun oxyanionen, molybdaat en wolframaat.
Bij sommige enzymen, zoals xanthine-oxidase, is het metaal gebonden aan één molybdopterine, maar bij DMSO-reductase is het metaal gebonden aan twee cofactoren.[7]
Modellen voor de actieve plaatsen van enzymen die molybdopterine bevatten, zijn gebaseerd op een klasse liganden die bekend staan als dithiolenen.[8]
Wolfraamderivaten
Sommige bacteriële oxidoreductasen gebruiken wolfraam op een soortgelijke manier als molybdeen door andere levensvormen toegepast wordt. Wolfraam neemt de plaats in van molybdeen in het pterinecomplex met molybdopterine. Molybdopterine kan dus een complex vormen met zowel molybdeen of wolfraam. Enzymen die wolfraam gebruiken, reduceren doorgaans vrije carbonzuren tot aldehyden.[9]
Het eerst ontdekte wolfraam-afhankelijke enzym heeft ook selenium nodig (hoewel de precieze vorm daarvan onbekend is). Er is gespeculeerd dat het wolfraam-seleniumpaar analoog functioneert aan de molybdeen-zwavel-koppel in sommige enzymen die een MOCO nodig hebben.[10] Hoewel is vastgesteld dat een wolfraambevattend xanthinedehydrogenase uit bacteriën wolfraammolybdopterine en niet-proteïnegebonden selenium bevat (waarmee de mogelijkheid van selenium in selenocysteïne- of selenomethionine-vorm is uitgesloten), is een wolfraam-seleniummolybdopterinecomplex nog niet definitief beschreven.[11]
Enzymen die molybdopterine gebruiken
Hieronder staan enzymen die molybdopterine gebruiken als cofactor of prothetische groep. Molybdopterine is een:[3]
- Cofactor van: xanthine-oxidase, DMSO-reductase, sulfiet-oxidase, nitraat-reductase, ethylbenzeen-dehydrogenase, glyceraldehyde-3-fosfaat-ferredoxine-oxidoreductase, respiratoire arsenaat-reductase, koolmonoxide-dehydrogenase, aldehyde-oxidase .
- Prostetische groep van: formiaatdehydrogenase, purinehydroxylase, thiosulfaatreductase.
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Molybdopterin op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ (en) HPEUEJRPDGMIMY-UHFFFAOYSA-N. pubchem.ncbi.nlm.nih.gov. Geraadpleegd op 4 February 2019. “IUPAC Name [2-amino-4-oxo-6,7-bis(sulfanyl)-3,5,5~{a},8,9~{a},10-hexahydropyrano[3,2-g]pteridin-8-yl]methyl dihydrogen phosphate”
- ↑ Pimkov, Igor V.; Serli-Mitasev, Barbara; Peterson, Antoinette A.; Ratvasky, Stephen C.; Hammann, Bernd; Basu, Partha (2015). Designing the Molybdopterin Core through Regioselective Coupling of Building Blocks. Chemistry – A European Journal 21 (47), pag.: 17057–17072. PMID: 26541355. DOI: 10.1002/chem.201502845.
- ↑ a b Structure, synthesis, empirical formula for the di-sulfhydryl.. [ Gearchiveerd van origineel] op 4 juni 2016. Geraadpleegd op 2025 06 05.
- ↑ a b Hover BM, Tonthat NK, Schumacher MA, Yokoyama K (May 2015). Mechanism of pyranopterin ring formation in molybdenum cofactor biosynthesis. Proc Natl Acad Sci USA 112 (20), pag.: 6347–52. PMID: 25941396. PMC: 4443348. DOI: 10.1073/pnas.1500697112.
- ↑ a b Hover BM, Loksztejn A, Ribeiro AA, Yokoyama K (April 2013). Identification of a cyclic nucleotide as a cryptic intermediate in molybdenum cofactor biosynthesis. J Am Chem Soc 135 (18), pag.: 7019–32. PMID: 23627491. PMC: 3777439. DOI: 10.1021/ja401781t.
- ↑ Mendel, R. R., Leimkuehler, S. (2015). The biosynthesis of the molybdenum cofactors. J. Biol. Inorg. Chem. 20 (2), pag.: 337–347. PMID: 24980677. DOI: 10.1007/s00775-014-1173-y.
- ↑ Schwarz, G., Mendel, R. R. (2006). Molybdenum cofactor biosynthesis and molybdenum enzymes. Annual Review of Plant Biology 57 (1), pag.: 623–647. PMID: 16669776. DOI: 10.1146/annurev.arplant.57.032905.105437.
- ↑ Kisker, C., Schindelin, H., Baas, D. (1999). A structural comparison of molybdenum cofactor-containing enzymes. FEMS Microbiol. Rev. 22 (5): 503–521. PMID 9990727. DOI: 10.1111/j.1574-6976.1998.tb00384.x.
- ↑ Lassner, Erik (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys and Chemical Compounds, pag.: 409–411 (Springer).. ISBN 978-0-306-45053-2.
- ↑ Stiefel, E. I. (1998). Transition metal sulfur chemistry and its relevance to molybdenum and tungsten enzymes. Pure Appl. Chem. 70 (4), pag.: 889–896. DOI: 10.1351/pac199870040889. Gearchiveerd van origineel op 9 juni 2025.
- ↑ Schräder T, Rienhöfer A, Andreesen JR (September 1999). Selenium-containing xanthine dehydrogenase from Eubacterium barkeri. Eur. J. Biochem. 264 (3), pag.: 862–71. PMID: 10491134. DOI: 10.1046/j.1432-1327.1999.00678.x.