Kupffercel

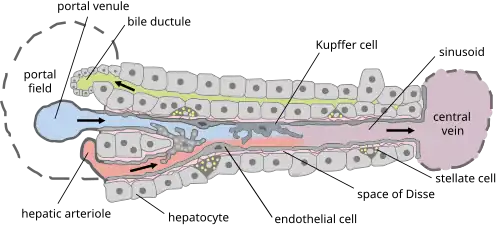
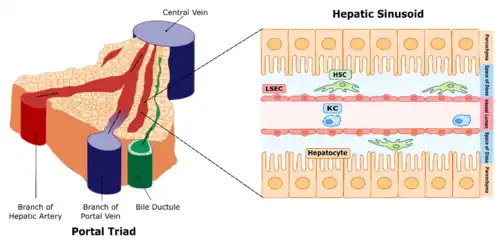
Kupffercellen, ook bekend als stellaatmacrofagen en Kupffer-Browicz-cellen, zijn gespecialiseerde cellen die zich in de lever bevinden in het lumen van de leversinusoïden en die vastzitten aan hun endotheelcellen die de bloedvatwanden vormen. De cellen werden voor het eerst waargenomen door Karl Wilhelm von Kupffer in 1876.[1] De wetenschapper noemde ze "Sternzellen" (stercellen of leverstellaatcellen), maar dacht, ten onrechte, dat ze een integraal onderdeel waren van het endotheel van de leverbloedvaten en dat ze daaruit voortkwamen. In 1898, na jarenlang onderzoek, identificeerde Tadeusz Browicz ze correct als macrofagen.[2][3][4][5]
Kupffercellen vormen de grootste populatie van in weefsel residerende macrofagen in het lichaam. Darmbacteriën, bacteriële endotoxinen en microbieel afval dat vanuit het maag-darmkanaal via de poortader naar de lever wordt getransporteerd, komen als eerste in contact met Kupffercellen, de eerste immuuncellen in de lever. Hierdoor kan elke verandering in de functies van Kupffercellen in verband worden gebracht met verschillende leverziekten, zoals alcoholische leverziekte, virale hepatitis, intrahepatische cholestase, steatohepatitis, activering of afstoting van de lever tijdens levertransplantatie en leverfibrose.[6][7] Het zijn professionele fagocyten.
Locatie en structuur
Kupffercellen zijn te vinden aan sinusoïdale endotheelcellen in zowel de centrilobulaire als de periportale regio's van de leverlobben. De functie en structuur van Kupffercellen zijn gespecialiseerd, afhankelijk van hun locatie. Periportale Kupffercellen zijn over het algemeen groter en vertonen meer lysosomale enzym- en fagocyterende activiteit, terwijl centrilobulaire Kupffercellen meer superoxideradicalen produceren.
Kupffercellen zijn amoeboïde van karakter, met oppervlaktekenmerken zoals microvilli, pseudopodia en lamellipodia, die in alle richtingen uitsteken. De microvilli en pseudopodia spelen een rol bij de endocytose van deeltjes.
De ovale celkern is ingedeukt en kan gelobd zijn.
Opvallende cytoplasmatische elementen zijn ribosomen, golgicomplex, centriolen, microtubuli en microfilamenten. Kupffercellen bevatten ook ruw endoplasmatisch reticulum (ENR), een kernmembraan en annulaire lamellen, die allemaal peroxidaseactiviteit vertonen.
Belangrijk is dat Kupffercellen de SR-AI/II-scavenger-receptor tot expressie brengen. Deze receptor is betrokken bij de herkenning en binding van het lipide A-domein van lipopolysaccharide (LPS) en lipoteichoïnezuur. (Lipopolysaccharide is een bacterieel endotoxine dat in de celwand van gramnegatieve bacteriën wordt aangetroffen, terwijl lipoteichoïnezuur aanwezig is in grampositieve bacteriën.) Vanwege dit detectiesysteem spelen Kupffercellen een cruciale rol bij het initiëren en bemiddelen van immuunreacties op bacteriële infecties van de lever.[8]
Ontwikkeling
De ontwikkeling van een initiële populatie Kupffercellen begint in de embryonale dooierzak, waar voorlopercellen differentiëren tot foetale macrofagen. Zodra ze in de bloedbaan terechtkomen, migreren ze naar de foetale lever, waar ze blijven. Daar voltooien ze hun differentiatie tot Kupffercellen. Onder normale omstandigheden leven deze Kupffercelpopulaties lang en vernieuwen ze zichzelf.[9] Het aantal Kupffercellen in de lever wordt constant gehouden. Kupffercellen hebben een proliferatief vermogen, waardoor celpopulaties zichzelf kunnen aanvullen
Als de residentiële Kupffercelpopulaties echter uitgeput raken, kunnen monocyten afkomstig van hematopoëtische stamcellen in het beenmerg en via de bloedsomloop naar de lever getransporteerd, ook volledig differentiëren tot echte Kupffercellen. In tegenstelling tot andere weefselmacrofagen, die continu moeten worden vernieuwd door circulerende monocyten, zijn deze van monocyten afkomstige Kupffercellen in staat tot zelfvernieuwing zodra een populatie is gevestigd.[10]
De ontwikkeling van volwassen Kupffercellen wordt gereguleerd door talrijke groeifactoren, waarbij de macrofaagkoloniestimulerende factor (CSF1) een sleutelrol speelt. Cytokinen die betrokken zijn bij type 2-ontsteking, zoals IL-4, kunnen ook de proliferatie van Kupffercellen stimuleren. In dierstudies is een tijdsbestek van 14 tot 21 dagen aangetoond voor volledige aanvulling van Kupffercelpopulaties. Ondanks de hoge instroom van monocyten en de hoge rijpingssnelheid, worden leverpopulaties van Kupffercellen zorgvuldig onderhouden. Kennelijk is er een hoge turnoversnelheid met een gemiddelde levensduur van een Kupffercel die wordt geschat op 3,8 dagen. Het uiteindelijke lot van Kupffercellen in vivo is echter nog niet volledig duidelijk.[8][11][7]
Functie
_Cropped.png)
De primaire functie van de Kupffercel is het verwijderen van vreemde deeltjes en verontreinigingen die afkomstig zijn van het leverportaalsysteem tijdens de passage door de lever. De Kupffercellen kunnen grote deeltjes opnemen door fagocytose en kleinere deeltjes door pinocytose.[8] Kupffercellen spelen een cruciale rol in de aangeboren reacties van het immuunsysteem. Ze zijn belangrijk voor de afweer van de gastheer en spelen een rol bij het metabolisme van veel verschillende stoffen, waaronder lipiden, eiwitcomplexen en kleine deeltjes. Ze zijn ook nuttig bij het verwijderen van apoptotische cellen uit de bloedbaan.[6][7]
Monocyt-afgeleide macrofagen hebben geen proliferatief vermogenen worden oude of defecte cellen verwijderd door apoptose en ook door fagocytering door naburige Kupffercellen.
Kupffercellen functioneren heterogeen, afhankelijk van hun locatie in de leverlobuli. Cellen in de periportale zone staan direct bloot aan de bloedstroom en vertonen een hogere lysosomale activiteit om binnenkomende vreemde stoffen efficiënter te verwerken. Cellen in de centrilobulaire zone daarentegen ervaren minder doorbloeding en beschikken over een grotere voorraad superoxide om diepe wonden en diep doordringendeinfecties te bestrijden.
Als reactie op infectie of irritatie kunnen Kupffercellen inflammatoire cytokinen, TNF-alfa, zuurstofradicalen en proteasen produceren. Overmatige productie van deze mediatoren is gekoppeld aan het ontstaan van leverschade.[8]
Naast het opruimen van bacteriën zijn Kupffercellen ook verantwoordelijk voor het recyclen van hemoglobine door oude rode bloedcellen te vernietigen via fagocytaire activiteit. De globineketens worden hergebruikt, terwijl het ijzerhoudende deel, heem, verder wordt afgebroken tot ijzer, dat wordt hergebruikt, en bilirubine, dat in hepatocyten wordt gekoppeld (geconjugeerd) aan glucuronzuur en als gal wordt uitgescheiden.
Helmy et al. identificeerden een receptor in Kupffercellen, de complementreceptor van de immunoglobulinefamilie (CRIg). Muizen zonder CRIg konden pathogenen die met het complementsysteem waren bedekt, niet opruimen. CRIg is geconserveerd in muizen en mensen en is een cruciaal onderdeel van het aangeboren immuunsysteem.[12]
Klinische betekenis
Kupffercellen zijn ongelooflijk plastische cellen die specifieke activeringstoestanden kunnen polariseren en verschillende functies kunnen vervullen in verschillende micro-omgevingen. M1 (klassieke activering) en M2 (alternatieve activering) duiden de twee uitersten van macrofaagpolarisatie aan. M1-gepolariseerde Kupffercellen produceren een grote hoeveelheid pro-inflammatoire cytokinen zoals TNF-α. Aan de andere kant produceren M2-gepolariseerde Kupffercellen een grote hoeveelheid ontstekingsremmende mediatoren, bijvoorbeeld IL-10.[13][8]
Kupffercellen spelen een rol in de pathogenese van een beschadigde lever als reactie op sepsis. De macrofagen in de lever activeren en geven zowel IL-1 als TNF-α af. Dit activeert op zijn beurt leukocyten en sinusoïdale endotheelcellen om ICAM-1 tot expressie te brengen. Dit resulteert in weefselschade aan het endotheel door proteasen, zuurstofradicalen, prostanoïden en andere stoffen afkomstig van leukocyten.
Activering van Kupffercellen draagt bij aan de pathogenese van zowel chronische als acute alcoholische leverziekte als reactie op ethanol-geïnduceerde leverschade, die veel voorkomt bij chronische alcoholisten. Chronisch alcoholisme en leverschade hebben te maken met een systeem met twee beschadigingen. Terwijl de eerste beschadiging direct is, gemedieerd door de directe toxiciteit van ethanol en de metabole bijproducten ervan, is de tweede beschadiging indirect, gemedieerd door een verhoogde opname van lipopolysacharide (endotoxine) uit de darm.
Ethanol verhoogt de permeabiliteit van het darmepitheel, waardoor endotoxine, geproduceerd door de darmflora, via de poortader uit het darmlumen in de lever lekt. De aanwezigheid van endotoxine induceert een sterke M1-polarisatie van Kupffercellen. Een grote hoeveelheid reactieve zuurstofsoorten, pro-inflammatoire cytokinen en chemokinen wordt geproduceerd door de geactiveerde Kupffercellen, wat leidt tot leverschade.
De cascade begint met endotoxine-gemedieerde activering van de Toll-like receptor 4 (TLR4) en CD14, receptoren op de Kupffercel die endotoxine internaliseren. Dit activeert op zijn beurt de transcriptie van pro-inflammatoire cytokinen en yumornecrosefactor α (TNFα), met gelijktijdige productie van superoxiden.
Cytokinen en superoxiden veroorzaken respectievelijk ontsteking en oxiderende schade, terwijl TNFα de leverstellaatcellen aanzet tot collageensynthese. Deze processen resulteren in fibrose, oftewel littekenvorming in de lever. Fibrose leidt uiteindelijk tot cirrose, een verlies van leverfunctie als gevolg van uitgebreide littekenvorming.[14]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Kupffer cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Haubrich WS (July 2004). Kupffer of Kupffer cells. Gastroenterology 127 (1): 16. PMID 15236167. DOI: 10.1053/j.gastro.2004.05.041.
- ↑ Szymańska R, Schmidt-Pospuła M (1979). [Studies of liver's reticuloendothelial cells by Tadeusz Browicz and Karl Kupffer. A historical outline]. Archiwum Historii Medycyny 42 (3): 331–6. PMID 386989.
- ↑ Stachura J, Gałązka K (December 2003). History and current status of Polish gastroenterological pathology. Journal of Physiology and Pharmacology 54 Suppl 3: 183–92. PMID 15075472.
- ↑ Śródka A, Gryglewski RW, Szczepański W (2006). Browicz or Kupffer cells?. Polish Journal of Pathology 57 (4): 183–5. PMID 17285760.
- ↑ Wake K (2009). [Browicz's phagocytic cells and Kupffer's 'so-called stellate cells']. Kaibogaku Zasshi 84 (1): 17–21. PMID 19413196.
- ↑ a b Nguyen-Lefebvre, Anh Thu, Horuzsko, Anatolij (2015). Kupffer Cell Metabolism and Function. Journal of Enzymology and Metabolism 1 (1). PMID 26937490. PMC 4771376.
- ↑ a b c Dixon, Laura J., Barnes, Mark, Tang, Hui, Pritchard, Michele T., Nagy, Laura E. (April 2013). Kupffer Cells in the Liver. Comprehensive Physiology 3 (2): 785–797. ISSN: 2040-4603. PMID 23720329. PMC 4748178. DOI: 10.1002/cphy.c120026.
- ↑ a b c d e Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020), "Histology, Kupffer Cell", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 29630278, bezocht 2020-08-25
- ↑ Naito M, Hasegawa G, Takahashi K (November 1997). Development, differentiation, and maturation of Kupffer cells. Microscopy Research and Technique 39 (4): 350–64. PMID 9407545. DOI: <350::AID-JEMT5>3.0.CO;2-L 10.1002/(SICI)1097-0029(19971115)39:4<350::AID-JEMT5>3.0.CO;2-L.
- ↑ Scott C, Zheng F, De Baetselier P, et al (27 January 2016). Bone marrow-derived monocytes give rise to self-renewing and fully differentiated Kupffer cells. Nature Communications 7, 10321 (2016). PMID 26813785. PMC 4737801. DOI: 10.1038/ncomms10321.
- ↑ (en) Chen, Jiajia, Deng, Xiaoyi, Liu, Yongjian, Tan, Qiuhua, Huang, Guidong (2020). Kupffer Cells in Non-alcoholic Fatty Liver Disease: Friend or Foe?. International Journal of Biological Sciences 16 (13): 2367–2378. PMID 32760204. PMC 7378652. DOI: 10.7150/ijbs.47143. Geraadpleegd op 31 augustus 2020.
- ↑ Helmy KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, Scales SJ, Ghilardi N, van Lookeren Campagne M (March 2006). CRIg: a macrophage complement receptor required for phagocytosis of circulating pathogens. Cell 124 (5): 915–27. PMID 16530040. DOI: 10.1016/j.cell.2005.12.039.
- ↑ (en) Zeng, Tao, Zhang, Cui-Li, Xiao, Mo, Yang, Rui, Xie, Ke-Qin (2016). Critical Roles of Kupffer Cells in the Pathogenesis of Alcoholic Liver Disease: From Basic Science to Clinical Trials. Frontiers in Immunology 7. ISSN: 1664-3224. PMID 27965666. PMC 5126119. DOI: 10.3389/fimmu.2016.00538.
- ↑ Wheeler MD (2003). Endotoxin and Kupffer cell activation in alcoholic liver disease. Alcohol Research & Health 27 (4): 300–6. PMID 15540801. PMC 6668869.