Hypofosforzuur
| Hypofosforzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
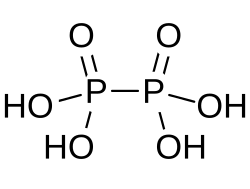
Structuur van Hypofosforzuur
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Hypodifosforzuur | |||
| Andere namen | Difosforzuur | |||
| Molmassa | 161,98 g/mol | |||
| SMILES | OP(O)(P(O)(O)=O)=O
| |||
| CAS-nummer | 7803-60-3 | |||
| PubChem | 24536 | |||
| Wikidata | Q4492149 | |||
| Beschrijving | (Didraat) witte vaste stof | |||
| Fysische eigenschappen | ||||
| Smeltpunt | 54 °C | |||
| Evenwichtsconstante(n) | pKz1 = 2.2, pKz2 = 2.8, pKz3 = 7.3, pKz4 = 10.0[1] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Hypofosforzuur valt onder de minerale zuren en heeft de formule waarbij forsfor een formeel oxidatiegetal heeft van +4. In vaste toestand komt het voor als het dihydraat: . De structuur is essentieel anders dan in de pyro- en polyfosfaten als ADP of ATP. Dat zijn per saldo zuuranhydrides waarbij de binding tussen de groepen via een zuurstof-atoom gerealiseerd wordt. In hypofosforzuur zijn de fosforatomen direct met elkaar verbonden door een fosfor-fosfor-binding. De twee fosfor-atomen zin chemisch identiek. In een structuurisomeer van deze verbinding Isohypofosforzuur is een van de fosforatomen aan waterstof gebonden en verloopt de koppeling van de fosfor-atomen via een zuurstofatoom. Daarmee is dat een gemengde valentieverbinding van fosfor, dat de oxidatiegetalen +3 en +5 heeft, en kan de stof beschouwd worden als een gemengd zuuranhydride van fosforzuur en fosfonzuur.
Synthese
De het dinatriumzout kan bij kamertemperatuur bereidt worden in een reactie van rode fosfor met natriumchloriet. Door tovoegen van aan het mengsel ontstaat het tetranatriumzout:[2]
Als witte fosfor, gedeeltelijk in water liggend, aan de lucht oxideert wordt een mengsel gevormd van hypofosforzuur, fosforzuur en fosforigzuur.[2]
Het tetra-natriumzout kristalliseert bij pH = 10, het dinatriumzout kristalliseert als dihydraat bij pH = 5,2.[1] Het dinatriumzout kan met behulp van een ionenwisselaar omgezet worden in het zuurdihydraat:[2]
Het watervrije zuur kan vervolgens verkregen worden door het dihydraat te drogen boven fosforpentoxide of uit de reactie van loodhypofosfaat met waterstofsulfide:[1]
Eigenschappen
Hypofosforzuur kan 4 waterstof-ionen afstaan, waarbij ook vier pKz constanten horen: 2,2; 2,8; 7,3 en 10,0.[1]
Watervrij hypofosforzuur disproportioneert bij staan: er ontstaat een mengsel van isohypfosforzuur , pyrofosforzuur en pyrofosforigzuur [1]
In heet zoutzuur is hypofosforzuur instabiel en hydrolyseert het naar fosforigzuur en fosforzuur .[1]
Structuur
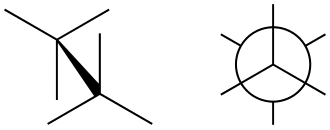
Het anion heeft een op vorm die veel lijkt op een gestaggerd ethaan-molecuul. De zuurstof-atomen aan de twee fosfor-atomen geven elkaar zoveel mogelijk ruimte, en de atomen aan het achterste fosfor-atoom zijn, kijkend langs de as van de fosfor-fosfor-binding, tussen de atomen aan het voorste fosfor-atoom te zien.
Als vast dihydraat bevat het zuur oxonium-ionen en kan het best beschreven worden als . Het dihydraat is hiermee isostructureel met het diammoniumzout waarvoor de lengte van de binding tussen de fosfor-atomen is vastgesteld op 219 nm. De vorm van het anion vertoont erg veel gelijkenis met de staggered vorm van het ethaan-molecuul.[2]
In het heptahydraat van het dinatriumzout wordt dezelfde afstand tussen de fosfor-atomen gevonden. Een ander aspect van de structuur van het anion in die stof is het feit dat elk fosfor-atoom twee zuurstof-atomen op een afstand van 151 pm heeft en een OH-groep op 159 nm.[3]
Hypofosfaatzouten
Met dit anion is een groot aantal zouten bekend, waaronder:
Bij staan aan de lucht hebben hypofosfaten de neiging te oxideren tot pyrofosfaat, met het -ion, waarin fosfor een oxidatiegetal van +5 heeft. Hypofosfaten zijn stabiel ten opzichte van de alkalihydroxides, maar in gesmolten natriumhydroxide worden ze snel omgezet in gewone fosfaten.[2]
Polyhypofosfaten
Polyhypofosfaten zijn bekend waarin lineaire anionen voorkomen, zoals waarin het ion voorkomt met een -keten en met het anion met een keten van 4 fosfor-atomen. Het cyclische anion [4] ontstaat als een suspensie van rode fosfor in kaliumhydroxide wordt geoxideerd met broom.[2]
Zie ook
- Dithionzuur, het zwavel-equivalent.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Hypophosphoric acid op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b c d e f Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 515–516. ISBN 978-0-08-022057-4
- ↑ a b c d e f Phosphorus: Chemistry, Biochemistry and Technology, Sixth Edition, 2013, D.E.C. Corbridge, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ↑ Collin, R. L.; Willis, M. (1971). The crystal structure of disodium dihydrogen hypophosphate hexahydrate and disodium dihydrogen pyrophosphate hexahydrate . Acta Crystallographica Section B 27 (2), pag.: 291–302. ISSN: 0567-7408. DOI: 10.1107/S0567740871002127.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, p. 715, ISBN 0-12-352651-5