Glycosylering
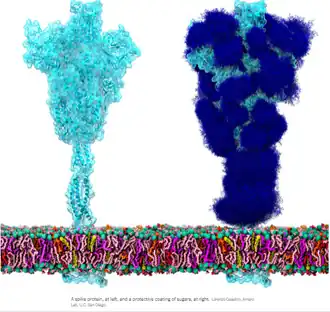
Glycosylering is een enzymatisch proces waarbij suikerketens (glycanen) covalent worden gebonden aan eiwitten of lipiden. Het is een van de meest voorkomende en complexe vormen van posttranslationele modificatie in eukaryotische cellen. Glycosylering vindt voornamelijk plaats in het endoplasmatisch reticulum en het golgiapparaat, waar de suikerketens stap voor stap worden opgebouwd en gemodificeerd.
Er zijn verschillende vormen van glycosylering. De meest algemene vorm is N-glycosylering (waar de suiker aan een asparagine wordt gekoppeld). Deze vorm komt voor op op 90% van alle glycoproteïnen. Een andere, minder voorkomende vorm is O-glycosylering (aan een serine of threonine). N-gekoppelde suikerketens komen wijdverspreid voor in cellen en zijn essentieel voor onder andere eiwitvouwing, cel–celcommunicatie en mechanismen in het immuunsysteem.
Stoornissen in glycosylering kunnen leiden tot ernstige aangeboren aandoeningen. Daarnaast is glycosylering van groot belang in de ontwikkeling en productie van biotechnologische geneesmiddelen; de juiste toevoeging van suikerketens beïnvloedt bijvoorbeeld in sterke mate de werkzaamheid en veiligheid van therapeutische eiwitten (monoklonale antilichamen, vaccins). Het onderzoeksgebied dat zich bezighoudt met glycosylering en glycanen heet glycobiologie.
Biologische functies
De enorme hoeveelheid glycoproteïnen en de complexe routes die in de evolutie ontstaan zijn om hen te synthetiseren, zijn een sterke aanwijzing dat de oligosachariden op glycoproteïnen en glycosfingolipiden zeer belangrijke functies hebben. Een grote groep van genetische aandoeningen bij de mens, bekend als congenitale defecten van de glycosylering, wordt veroorzaakt door erfelijke mutaties in de enzymen die betrokken zijn bij de modificatie van suikerstructuren op eiwitten en lipiden.[2]
Eiwitvouwing
N-glycosylering komt algemeen voor in alle eukaryoten, waaronder gistcellen. N-gekoppelde suikerketens komen zelfs voor in celwand-eiwitten van archaea, wat erop wijst dat de machinerie die nodig is voor hun synthese evolutionair zeer oud is. Een van de primaire functies van N-glycosylering is sturing van eiwitvouwing. N-glycosylering bevordert eiwitvouwing op twee manieren. Ten eerste speelt het een directe rol bij het beter oplosbaar maken van het ongevouwen eiwit, waardoor aggregatie wordt voorkomen. Ten tweede zorgen de opeenvolgende modificaties van het N-gebonden oligosacharide voor een zogenaamde glyco-code die de voortgang van de eiwitvouwing bestuurt. De code wordt gebruikt door chaperonne-eiwitten en lectines in het ER om eiwitvouwing en -afbraak te begeleiden. Suikerketens spelen ook een rol bij het transport en de sortering van eiwitten in golgiapparaat.
Bescherming en celadhesie
Omdat suikerketens beperkte bewegingsvrijheid hebben, kan zelfs een kleine oligosacharide dat uitsteekt van het oppervlak van een glycoproteïne de benadering van andere macromoleculen tot het eiwit beperken. Op deze manier maakt de aanwezigheid van oligosachariden een glycoproteïne bijvoorbeeld beter bestand tegen afbraak door proteolytische enzymen. Vermoedelijk boden suikerketens vroeg in de evolutie een beschermende laag rondom cellen; in vergelijking met de rigide bacteriële celwand heeft een dunne koolhydraatlaag het voordeel dat de cel haar vorm kan veranderen en zich kan verplaatsen.
De suikerketens hebben later in de evolutie andere functies gekregen. De slijmvliezen van long- en darmcellen zijn rijk aan membraangebonden glycanen (evenals uitgescheiden glycanen), en deze bieden bescherming tegen vele ziekteverwekkers. De herkenning van suikerketens door lectines in het extracellulaire ruimte is belangrijk bij veel ontwikkelingsprocessen en bij cel–celherkenning. Een noemenswaardige groep transmembraanlectines zijn selectinen, die een rol spelen bij cel-celadhesie tijdens de migratie van bloedcellen.
In het immuunsysteem
In het aangeboren immuunsysteem zijn suikerstructuren een bepalend belang voor de gastheer-pathogeeninteractie. Veel membraan-omgeven virussen en bacteriën (waaronder SARS-CoV-2, HIV en tuberculosebacterie) hebben glycanen op hun oppervlak die herkend kunnen worden door lectinereceptoren op aangeboren immuuncellen. Bekend zijn mannosebindend lectine (MBL) en vele typen C-type lectinereceptoren (zoals DC-SIGN), die allemaal specifieke suikerpatronen herkennen. Na binding aan de glycaanstructuur kunnen zulke receptoren de cel aanzetten tot fagocytose en antigeenpresentatie, of bijvoorbeeld het complementsysteem in gang zetten. Deze vroege herkenning vormt een essentieel onderdeel van de immuunrespons.
Glycosyleringspatronen op lichaamscellen veranderen voortdurend. Tijdens infectie met een pathogeen, bij ontstekingsreacties en bij kankercellen is expressie van glycanen anders dan op een gezonde cel. De veranderde glycosylering kan grote gevolgen hebben: bij kankercellen speelt dit verschijnsel bijvoorbeeld een rol bij ontsnapping aan het immuunsysteem. Omdat tumorglycanen vaak uniek zijn voor een bepaald kankertype, zijn ze in de belangstelling gekomen als biomarker (bijvoorbeeld voor vroege detectie van kanker) en als doelwit voor therapieën, zoals tumorvaccins of antistoffen die specifiek glycanen herkennen.
De aanwezigheid van suikerketens kan de antigene en functionele eigenschappen van een eiwit wijzigen, waardoor glycosylering een belangrijke factor is bij de productie van eiwitten voor farmaceutische toepassingen. Bij de productie van biologische geneesmiddelen (in celkweek) wordt zorgvuldig gecontroleerd of de glycosylering overeenkomt met die van natuurlijke menselijke eiwitten. Onjuiste glycosylering kan namelijk leiden tot verminderde werking van het medicijn, snellere afbraak in het lichaam, of zelfs een ongewenste immuunreactie.
Zie ook
- ↑ (en) Casalino L, Gaieb Z, Goldsmith JA, Fadda E, Amaro RE. (2020). Beyond Shielding: The Roles of Glycans in the SARS-CoV-2 Spike Protein. ACS Central Science 6 (10): 1722–1734. PMID 33140034. DOI: 10.1021/acscentsci.0c01056.
- ↑ (en) Chang I, He M, Lam CT. (2018). Congenital disorders of glycosylation. Annals of Translational Medicine 6 (24): 477–477. DOI: 10.21037/atm.2018.10.45.