Epidermale groeifactor receptor
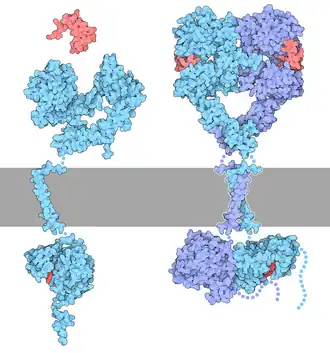
De epidermale groeifactor receptor (EGFR; ErbB-1; HER1 bij mensen) is een dimeer transmembraaneiwit dat een receptor is voor leden van de epidermale groeifactorfamilie (EGF-familie) van extracellulaire proteïneliganden.[1] Het is 170-kDa groot en is samengesteld uit twee monomeren (samengesteld uit twee alfa/bèta-subeenheden). De alfa-subeenheid zal de koppeling van de epidermale groeifactor (EGF) mogelijk maken en de bèta-subeenheid van de EGFR kan de tyrosineresiduen van andere receptoren waarmee het is geaggregeerd fosforyleren (cross-fosforylatie) en daardoor zichzelf activeren. De epidermale groeifactor receptor brengt het signaal over na zijn binding aan de epidermale groeifactor. Het is een eiwit met intrinsieke tyrosinekinaseactiviteit. Het heeft overeenkomsten met de insuline receptor. Het behoort tot de receptor-tyrosinekinase (RTK)-familie van receptoren met tyrosinekinase-activiteit.
De epidermale groeifactor receptor is een lid van de ErbB-receptorfamilie, een subfamilie van vier nauw verwante receptortyrosinekinasen: EGFR (ErbB-1), HER2/neu (ErbB-2), Her 3 (ErbB-3) en Her 4 (ErbB-4). Bij veel soorten kanker kunnen mutaties die de EGFR-expressie of -activiteit beïnvloeden, leiden tot kanker.[2]
Epidermale groeifactor en zijn receptor werden ontdekt door Stanley Cohen van de Vanderbilt University. Cohen deelde de Nobelprijs voor Geneeskunde in 1986 met Rita Levi-Montalcini voor hun ontdekking van groeifactoren.
Deficiënte signalering van de EGFR en andere receptortyrosinekinasen bij mensen wordt geassocieerd met ziekten zoals Alzheimer, terwijl overexpressie geassocieerd wordt met de ontwikkeling van een grote verscheidenheid aan tumoren. Onderbreking van EGFR-signalering, hetzij door het blokkeren van EGFR-bindingsplaatsen op het extracellulaire domein van de receptor of door het remmen van intracellulaire tyrosinekinase-activiteit, kan de groei van EGFR-expressieve tumoren voorkomen en de conditie van de patiënt verbeteren.
Functie
Epidermale groeifactorreceptor (EGFR) is een transmembraaneiwit dat wordt geactiveerd door binding van zijn specifieke liganden, waaronder epidermale groeifactor en transforming growth factor alpha (TGF-α).[3] ErbB2 heeft geen bekende directe activerende ligand en kan zich constitutief in een geactiveerde toestand bevinden of actief worden na heterodimerisatie met andere familieleden zoals EGFR. Na activering door zijn groeifactorliganden ondergaat EGFR een overgang van een inactieve monomere vorm naar een actieve homodimeer.[4] – hoewel er enig bewijs is dat vooraf gevormde inactieve dimeren ook kunnen bestaan vóór ligandbinding.[5] Naast het vormen van homodimeren na ligandbinding, kan EGFR paren met een ander lid van de ErbB2-receptorfamilie, zoals ErbB2/Her2/neu, om een geactiveerd heterodimeer te vormen. Er zijn ook aanwijzingen dat er clusters van geactiveerde EGFR's ontstaan, hoewel het onduidelijk blijft of deze clustering belangrijk is voor de activering zelf of dat deze plaatsvindt na de activering van individuele dimeren.[6]
Signaaltransductie
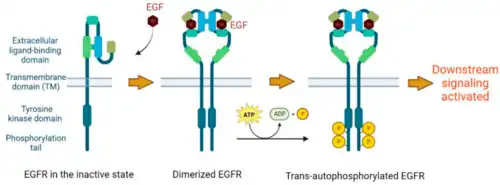
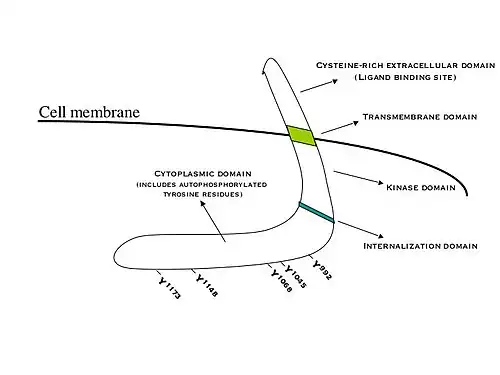
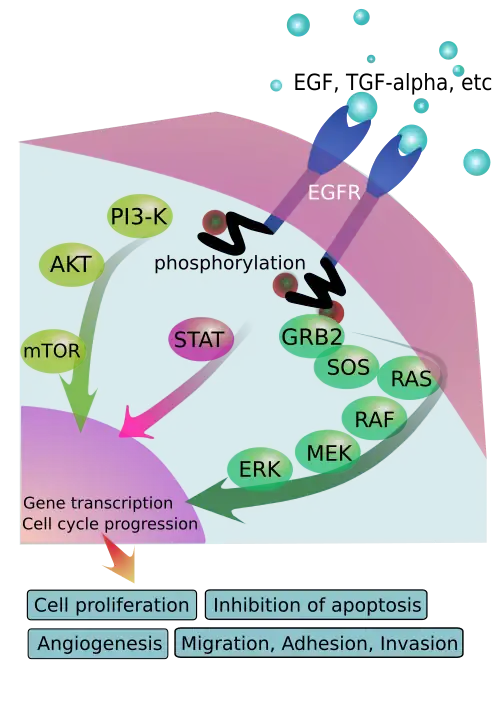
Epidermale groeifacto (EGF) is een hydrofiel eiwit en kan daarom het hydrofobe celmembraan niet passeren. De overdracht van informatie binnen de cel vindt plaats door binding aan de specifieke EGF-receptor (EGFR). Deze binding induceert dimerisatie van de receptor. EGFR-dimerisatie stimuleert de intrinsieke intracellulaire proteïne-tyrosinekinase-activiteit. Als gevolg hiervan vindt autofosforylering van verschillende tyrosine (Y)-residuen in het C-terminusdomein van EGFR plaats. Deze omvatten Y992, Y1045, Y1068, Y1148 en Y1173, zoals weergegeven in het aangrenzende diagram.[11] Gefosforyleerde tyrosinen dienen als anker- of koppelpunt voor eiwitten in het SH2-domein (SRC-homologiedomein) en maken interactie met andere eiwitten mogelijk.
Vier belangrijke eiwitten van dit type binden aan de receptor:
- PLCy (Fosfolipase C-gamma);
- GRB2;
- GAP (GTPase-activerend proteïne);
- SRC (Rous-sarcoomproteïne).
Fosfolipase katalyseert de reactie PIP2 (fosfatidylinositolbifosfaat) → IP3 (inositoltrifosfaat) + DAG (diglyceride). IP3 verbindt zich met een ionkanaal in het endoplasmatisch reticulum, dat de afgifte van het calciumion veroorzaakt. DAG activeert PKC (een type C-proteïnekinase), die door het basale calciumniveau (100 nanomol per liter) onvoldoende wordt geactiveerd.
GRB2 heeft een SH3-domein dat de RasGEF (GDP-uitwisselingsfactor) rekruteert, waardoor het GDP (Guanosinedifosfaat). van een RAS-achtig G-eiwit wordt vervangen door een GTP (Guanosinetrifosfaat). RAS-GTP kan vervolgens een RAF kinase naar het membraan rekruteren, dat wordt gefosforyleerd door PKC (de reactie wordt gekatalyseerd door SRC). Raf1-P ligt aan de oorsprong van een reeks cascade-activaties door fosforylering van een reeks hyaloplasmatische MAP-kinasen; MEK en vervolgens ERK. In gefosforyleerde vorm (ERK-P) komt het de celkern binnen en activeert het verschillende transcriptiefactoren door fosforylering.
Gefosforyleerde RAF kan vervolgens een MAP-kinase (Mitogeen geactiveerd) fosforyleren en activeren, die op zijn beurt een MAP-kinase activeert. Deze laatste fosforyleert de transcriptiefactoren JUN en TCF die respectievelijk de expressie van de oncogenen Jun en Fos veroorzaken.
Deze route leidt dus vooral tot een toename van de transcriptieactiviteit van de cel en een toename van de DNA-replicatie, wat resulteert in een stimulering van de celgroei en -deling (mitose).
Activering van de receptor is belangrijk voor de aangeboren immuunrespons in de menselijke huid. Bovendien kan het kinasedomein van de EGFR de tyrosineresiduen van andere receptoren waarmee het is geaggregeerd fosforyleren (cross-fosforylatie) en daardoor zichzelf activeren.
Mutaties
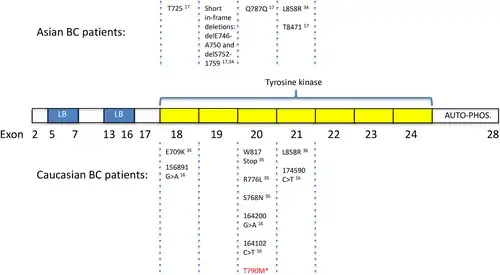
Het receptorgen ligt op chromosoom 7 (7p11.2).[7] Mutaties van het receptorgen worden in verband gebracht met verschillende vormen van kanker, met name borst- en longkanker.[8]. Belangrijkste veranderingen in een exon zijn:
- Exon 19: deleties (gevoeligheid voor tyrosinekinaseremmers - TKI's)
- Exon 20: inserties, T790M, wat een oorzaak is van behandelingsresistentie6. De mutatie vervangt een threonine (T) door een methionine (M) op positie 790 van exon 20,[9]. wat de ATP-bindingsplaats van het EGFR-kinasedomein beïnvloedt.
- Exon 21: missense substitutie-L858R
Bij één kind met epitheliale ontsteking van meerdere organen werd een homozygote mutatie gevonden, die een functieverlies veroorzaakte in het EGFR-gen. De pathogeniciteit van de EGFR-mutatie werd ondersteund door in vitro experimenten en functionele analyse van een huidbiopsie. Zijn ziek makend fenotype weerspiegelt veel eerdere onderzoeksresultaten naar EGFR-functie. Zijn klinische kenmerken omvatten een papulopustulaire rosacea, droge huid, chronische diarree, afwijkingen in haargroei, ademhalingsproblemen en elektrolytenonevenwichtigheden.[10]
Biologische rol
De EGFR is essentieel voor de buizenontwikkeling (ductuli) van de melkklieren,[11][12][13] en agonisten van de EGFR zoals amfireguline, TGF-α en hereguline induceren zowel de ontwikkeling buizen als klierzakjes, zelfs bij afwezigheid van oestrogeen en progesteron.[14][15]
Rol bij menselijke ziekten
Kanker
Mutaties die leiden tot overexpressie van EGFR (bekend als upregulatie) zijn in verband gebracht met een aantal vormen van kanker, waaronder adenocarcinoom van de long (40% van de gevallen), anale kankers,[16] glioblastoom (50%) en keelkanker (80-100%).[17] Deze somatische mutaties waarbij EGFR betrokken is, leiden tot constante activering ervan, wat leidt tot ongecontroleerde celdeling.[18] Bij glioblastoom wordt vaak een specifieke mutatie van EGFR, EGFRvIII genaamd, waargenomen.[19] Mutaties, upregulaties of misregulaties van EGFR of familieleden zijn betrokken bij ongeveer 30% van alle carcinomen.[20]
Ontstekingsziekte
Afwijkende EGFR-signalering is betrokken bij psoriasis, eczeem en atherosclerose.[21][22] De precieze rol die het speelt in deze omstandigheden is echter niet duidelijk.
Wondgenezing en fibrose
EGFR is aangetoond een cruciale rol te spelen in TGF-β1-afhankelijke fibroblast tot myofibroblast differentiatie.[23][24] Afwijkende afbreking van myofibroblasten in weefsels kan leiden tot progressieve weefselfibrose, waardoor weefsel- of orgaanfunctie wordt aangetast (bijv. hypertrofische huid of keloïd littekenweefsel, levercirrose, hartspierweefselfibrose, chronische nierziekte).
Medische toepassingen
De identificatie van EGFR als oncogen heeft geleid tot de ontwikkeling van antikankertherapieën gericht tegen EGFR (genaamd "EGFR-remmers", EGFRi), waaronder gefitinib,[25] erlotinib,[26] afatinib, brigatinib en icotinib[27][28] voor longkanker en cetuximab voor darmkanker. Meer recent heeft AstraZeneca osimertinib ontwikkeld, een tyrosinekinaseremmer van de derde generatie.[29][28]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Epidermal growth factor receptor op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Herbst RS (2004). Review of epidermal growth factor receptor biology. International Journal of Radiation Oncology, Biology, Physics 59 (2 Suppl): 21–6. PMID 15142631. DOI: 10.1016/j.ijrobp.2003.11.041.
- ↑ Zhang H, Berezov A, Wang Q, Zhang G, Drebin J, Murali R, Greene MI (August 2007). ErbB receptors: from oncogenes to targeted cancer treatment. The Journal of Clinical Investigation 117 (8): 2051–8. PMID 17671639. PMC 1934579. DOI: 10.1172/JCI32278.
- ↑ note, a full list of the ligands able to activate EGFR and other members of the ErbB family is given in the ErbB article)
- ↑ Yarden Y, Schlessinger J (March 1987). Epidermal growth factor induces rapid, reversible aggregation of the purified epidermal growth factor receptor. Biochemistry 26 (5): 1443–51. PMID 3494473. DOI: 10.1021/bi00379a035.
- ↑ Maruyama IN (April 2014). Mechanisms of activation of receptor tyrosine kinases: monomers or dimers. Cells 3 (2): 304–30. PMID 24758840. PMC 4092861. DOI: 10.3390/cells3020304.
- ↑ (en) Abulrob A, Lu Z, Baumann E, Vobornik D, Taylor R, Stanimirovic D, Johnston LJ (January 2010). Nanoscale imaging of epidermal growth factor receptor clustering: effects of inhibitors. The Journal of Biological Chemistry 285 (5): 3145–3156. PMID 19959837. PMC 2823441. DOI: 10.1074/jbc.M109.073338.
- ↑ My Cancer Genome
- ↑ Sharma SV, Bell DW, Settleman J, Haber DA, Epidermal growth factor receptor mutations in lung cancer, Nat Rev Cancer, 2007;7:169-181
- ↑ Sequist LV, Waltman BA, Dias-Santagata D et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors, Sci Transl Med, 2011;3:75ra26-75ra26
- ↑ Campbell P, Morton PE, Takeichi T, Salam A, Roberts N, Proudfoot LE, Mellerio JE, Aminu K, Wellington C, Patil SN, Akiyama M, Liu L, McMillan JR, Aristodemou S, Ishida-Yamamoto A, Abdul-Wahab A, Petrof G, Fong K, Harnchoowong S, Stone KL, Harper JI, McLean WH, Simpson MA, Parsons M, McGrath JA (October 2014). Epithelial inflammation resulting from an inherited loss-of-function mutation in EGFR. The Journal of Investigative Dermatology 134 (10): 2570–8. PMID 24691054. PMC 4090136. DOI: 10.1038/jid.2014.164.
- ↑ Sebastian J, Richards RG, Walker MP, Wiesen JF, Werb Z, Derynck R, Hom YK, Cunha GR, DiAugustine RP (September 1998). Activation and function of the epidermal growth factor receptor and erbB-2 during mammary gland morphogenesis. Cell Growth & Differentiation 9 (9): 777–85. PMID 9751121.
- ↑ McBryan J, Howlin J, Napoletano S, Martin F (June 2008). Amphiregulin: role in mammary gland development and breast cancer. Journal of Mammary Gland Biology and Neoplasia 13 (2): 159–69. PMID 18398673. DOI: 10.1007/s10911-008-9075-7.
- ↑ Sternlicht MD, Sunnarborg SW (June 2008). The ADAM17-amphiregulin-EGFR axis in mammary development and cancer. Journal of Mammary Gland Biology and Neoplasia 13 (2): 181–94. PMID 18470483. PMC 2723838. DOI: 10.1007/s10911-008-9084-6.
- ↑ Kenney NJ, Bowman A, Korach KS, Barrett JC, Salomon DS (May 2003). Effect of exogenous epidermal-like growth factors on mammary gland development and differentiation in the estrogen receptor-alpha knockout (ERKO) mouse. Breast Cancer Research and Treatment 79 (2): 161–73. PMID 12825851. DOI: 10.1023/a:1023938510508.
- ↑ Kenney NJ, Smith GH, Rosenberg K, Cutler ML, Dickson RB (December 1996). Induction of ductal morphogenesis and lobular hyperplasia by amphiregulin in the mouse mammary gland. Cell Growth & Differentiation 7 (12): 1769–81. PMID 8959346.
- ↑ Walker F, Abramowitz L, Benabderrahmane D, Duval X, Descatoire V, Hénin D, Lehy T, Aparicio T (November 2009). Growth factor receptor expression in anal squamous lesions: modifications associated with oncogenic human papillomavirus and human immunodeficiency virus. Human Pathology 40 (11): 1517–27. PMID 19716155. DOI: 10.1016/j.humpath.2009.05.010.
- ↑ Kumar V, Abbas A, Aster J (2013). Robbins basic pathology. Elsevier/Saunders, Philadelphia, p. 179. ISBN 9781437717815.
- ↑ Lynch TJ, Bell DW, Sordella R, Gurubhagavatula S, Okimoto RA, Brannigan BW, Harris PL, Haserlat SM, Supko JG, Haluska FG, Louis DN, Christiani DC, Settleman J, Haber DA (May 2004). Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. The New England Journal of Medicine 350 (21): 2129–39. PMID 15118073. DOI: 10.1056/NEJMoa040938.
- ↑ Kuan CT, Wikstrand CJ, Bigner DD (June 2001). EGF mutant receptor vIII as a molecular target in cancer therapy. Endocrine-Related Cancer 8 (2): 83–96. PMID 11397666. DOI: 10.1677/erc.0.0080083.
- ↑ Zhen Y, Guanghui L, Xiefu Z (November 2014). Knockdown of EGFR inhibits growth and invasion of gastric cancer cells. Cancer Gene Therapy 21 (11): 491–7. PMID 25394504. DOI: 10.1038/cgt.2014.55.
- ↑ Jost M, Kari C, Rodeck U (2000). The EGF receptor – an essential regulator of multiple epidermal functions. European Journal of Dermatology 10 (7): 505–10. PMID 11056418.
- ↑ Dreux AC, Lamb DJ, Modjtahedi H, Ferns GA (May 2006). The epidermal growth factor receptors and their family of ligands: their putative role in atherogenesis. Atherosclerosis 186 (1): 38–53. PMID 16076471. DOI: 10.1016/j.atherosclerosis.2005.06.038.
- ↑ Midgley AC, Rogers M, Hallett MB, Clayton A, Bowen T, Phillips AO, Steadman R (May 2013). Transforming growth factor-β1 (TGF-β1)-stimulated fibroblast to myofibroblast differentiation is mediated by hyaluronan (HA)-facilitated epidermal growth factor receptor (EGFR) and CD44 co-localization in lipid rafts. The Journal of Biological Chemistry 288 (21): 14824–38. PMID 23589287. PMC 3663506. DOI: 10.1074/jbc.M113.451336.
- ↑ Midgley AC, Bowen T, Phillips AO, Steadman R (April 2014). MicroRNA-7 inhibition rescues age-associated loss of epidermal growth factor receptor and hyaluronan-dependent differentiation in fibroblasts. Aging Cell 3 (2): 235–44. PMC pmid=24134702 4331777 pmid=24134702. DOI: 10.1111/acel.12167.
- ↑ Paez JG, Jänne PA, Lee JC, Tracy S, Greulich H, Gabriel S, Herman P, Kaye FJ, Lindeman N, Boggon TJ, Naoki K, Sasaki H, Fujii Y, Eck MJ, Sellers WR, Johnson BE, Meyerson M (June 2004). EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 304 (5676): 1497–1500. PMID 15118125. DOI: 10.1126/science.1099314.
- ↑ Gijtenbeek RG, van der Noort V, Aerts JG, Staal-van den Brekel JA, Smit EF, Krouwels FH, Wilschut FA, Hiltermann TJ, Timens W, Schuuring E, Janssen JD, Goosens M, van den Berg PM, de Langen AJ, Stigt JA, van den Borne BE, Groen HJ, van Geffen WH, van der Wekken AJ (October 2022). Randomised controlled trial of first-line tyrosine-kinase inhibitor (TKI) versus intercalated TKI with chemotherapy for EGFR-mutated nonsmall cell lung cancer. ERJ Open Research 8 (4): 00239–2022. PMID 36267895. PMC 9574558. DOI: 10.1183/23120541.00239-2022.
- ↑ Liang W, Wu X, Fang W, Zhao Y, Yang Y, Hu Z, Xue C, Zhang J, Zhang J, Ma Y, Zhou T, Yan Y, Hou X, Qin T, Dinglin X, Tian Y, Huang P, Huang Y, Zhao H, Zhang L (12 February 2014). Network meta-analysis of erlotinib, gefitinib, afatinib and icotinib in patients with advanced non-small-cell lung cancer harboring EGFR mutations. PLOS ONE 9 (2): e85245. PMID 24533047. PMC 3922700. DOI: 10.1371/journal.pone.0085245.
- ↑ a b Gijtenbeek RG, Damhuis RA, van der Wekken AJ, Hendriks LE, Groen HJ, van Geffen WH (April 2023). Overall survival in advanced epidermal growth factor receptor mutated non-small cell lung cancer using different tyrosine kinase inhibitors in The Netherlands: a retrospective, nationwide registry study. The Lancet Regional Health. Europe 27: 100592. PMID 36817181. PMC 9932646. DOI: 10.1016/j.lanepe.2023.100592.
- ↑ Greig SL (February 2016). Osimertinib: First Global Approval. Drugs 76 (2): 263–273. PMID 26729184. DOI: 10.1007/s40265-015-0533-4.