Eiwitdynamiek
Eiwitdynamiek (Engels: protein dynamics) beschrijft de interne bewegingen en conformatie-veranderingen die eiwitten ondergaan tijdens hun functioneren. Hoewel eiwitten vaak worden voorgesteld als vaste structuren die rechtstreeks bepaald worden door hun aminozuurvolgorde, blijkt uit structuurbiologisch en biofysisch onderzoek dat dit een simplistisch beeld is. Eiwitten zijn in werkelijkheid een verzameling van conformaties die onderling in evenwicht staan. Deze veranderingen – die variëren van kleine verschuivingen in zijketens tot grootschalige domeinbewegingen – spelen een cruciale rol in de biologische functie van eiwitten, waaronder enzymatische katalyse, moleculaire herkenning en allosterische regulatie.
Bewegingen binnen eiwitten vinden plaats over verschillende lengteschalen (van ångströms tot nanometers) en tijdsschalen (van picoseconden tot vele seconden). Tijdens allosterie is er bijvoorbeeld sprake van relatief langzame domeinbewegingen over nanometerschaal.[1] Om eiwitdynamiek te bestuderen, maken onderzoekers gebruik van een combinatie van experimentele technieken, zoals NMR-spectroscopie, röntgendiffractie en cryo-EM, en van computationele modellen zoals MD-simulaties.
Analyse van eiwitdynamiek omvat zowel kinetische aspecten – de snelheden en routes van overgang tussen toestanden – als thermodynamische aspecten, zoals de relatieve stabiliteit en populatieverdeling van deze toestanden. Deze twee invalshoeken worden vaak geïntegreerd via het concept van het 'energielandschap', waarin de mogelijke conformaties van een eiwit worden voorgesteld als valleien gescheiden door energiebarrières. De diepte van een vallei weerspiegelt de stabiliteit van een conformatie; de hoogte van de barrière bepaalt hoe waarschijnlijk en hoe snel een overgang naar een andere toestand plaatsvindt.[2]
Lokale flexibiliteit
Eiwitten zijn dynamische moleculen, zelfs in hun gevouwen toestand. De beweging op atoomschaal, dus van atomen of afzonderlijke zijketens binnen het eiwitmolecuul, worden lokale bewegingen genoemd. Ze komen voort uit stochastische fluctuaties van chemische bindingen en bindingshoeken. Zijketens van aminozuren kunnen ook tussen afzonderlijke discrete energieminima springen: conformatie-isomeren (rotamers).[3][4]
Bewijs voor lokale flexibiliteit wordt vaak verkregen uit NMR-spectroscopie. Flexibiliteit in gevouwen eiwitten kan worden geïdentificeerd door de kernspinrelaxatie van individuele atomen in het eiwit te analyseren. Flexibiliteit kan ook worden waargenomen in electron density maps door middel van röntgenkristallografie,[5] vooral wanneer de diffractiegegevens worden verzameld bij kamertemperatuur in plaats van bij de traditionele cryogene temperatuur (meestal nabij 100 K).[6] Informatie over de frequentieverdeling en dynamiek van lokale eiwitflexibiliteit kan worden verkregen met behulp van Raman- en optische Kerr-effectspectroscopie.[7]
Regionale flexibiliteit
In een gevouwen eiwit liggen de aminozuurresiduen, dat wil zeggen de individuele aminozuurbouwstenen in de eiwitketen, vaak dicht bij elkaar. Dit kunnen residuen zijn die naast elkaar liggen in de primaire sequentie, of door vouwing van de polypeptideketen bij elkaar worden gebracht. De aminozuurresiduen kunnen elkaar afstoten of aantrekken door fysisch-chemische interacties zoals waterstofbruggen, ionische bindingen, vanderwaalskrachten en elektrostatische interacties. Deze interacties bepalen de interne beweeglijkheid van het eiwit als geheel.
Regionale flexibiliteit is het meest uitgesproken bij residuen aan het oppervlak (surface-exposed residues), die vaak zeer verschillende conformaties aannemen in kristalstructuren. Conformationele variatie komt ook voor binnen secundaire structuurelementen.[8] In α-helices vinden vaak interacties plaats tussen residuen die vier posities van elkaar verwijderd zijn in de primaire sequentie. In β-sheets wijzen residuen die twee posities van elkaar liggen meestal met hun zijketens naar dezelfde kant, waardoor ze dicht genoeg bij elkaar liggen om sterische interacties aan te gaan – net als residuen op aangrenzende strengen van dezelfde β-sheet. Sommige van deze conformationele veranderingen worden veroorzaakt door posttranslationele modificaties van de eiwitstructuur, zoals fosforylering en methylering.[8][9]
Globale flexibiliteit: beweging van domeinen

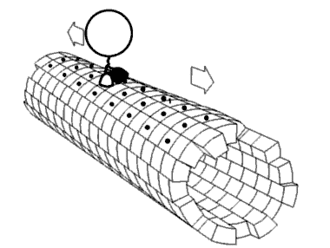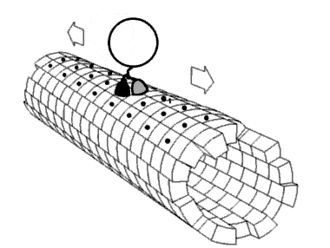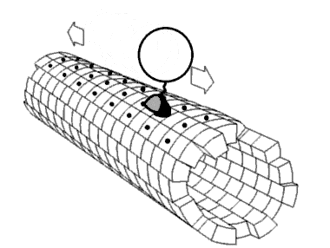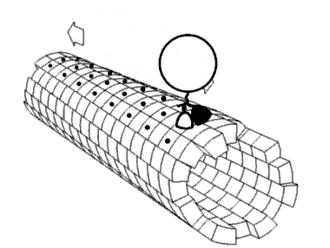
Eiwitten bestaan vaak uit meerdere domeinen — afzonderlijke, gevouwen eenheden binnen één eiwitketen — en deze opbouw zorgt voor relatief veel flexibiliteit. De bewegingen van deze domeinen ten opzichte van elkaar, ook wel domain dynamics genoemd, kunnen een belangrijke rol spelen in de functie van het eiwit. Zulke bewegingen zijn op verschillende manieren te bestuderen: direct met spectroscopische technieken, of indirect door simulaties zoals moleculaire dynamica of door het vergelijken van verschillende kristalstructuren van hetzelfde eiwit. Dergelijke domeinbewegingen blijken een rol te hebben in uiteenlopende processen, waaronder enzymatische katalyse, transport van moleculen door membranen, signaaltransductie (mechanotransductie), beweging van motoreiwitten, en de vorming van eiwitcomplexen.[1]
Een bekend voorbeeld van een grote domeinbeweging is te vinden in het enzym pyruvaatfosfaat-dikinase, waar een domein 'draait' om een fosfaatgroep van het ene actieve centrum naar het andere te brengen — een beweging van ongeveer 100 graden over een afstand van 45 ångström.[10]
In veel enzymen sluit een domein zich over een ander om een substraat, een proces dat bekend staat als induced fit. Dit fenomeen is van belang voor het de reactieomgeving. Domeinbewegingen kunnen grofweg worden onderverdeeld in twee typen: een 'scharnierbeweging', waarbij domeinen als een deur openen of sluiten, en een 'schuifbeweging', waarbij domeinen langs elkaar glijden. Meestal zijn het slechts kleine delen van het eiwit, zoals de verbindingsstukken tussen domeinen en enkele zijketens, die daadwerkelijk van conformatie veranderen bij deze bewegingen.[11]
Zie ook
- ↑ a b (en) Bu Z, Callaway DJ (2011). Protein Structure and Diseases. Academic Press, "Proteins move! Protein dynamics and long-range allostery in cell signaling", 163–221. ISBN 9780123812629.
- ↑ (en) Frauenfelder H, Sligar SG, Wolynes PG (1991). The energy landscapes and motions of proteins. Science 254 (5038): 1598–1603. PMID 1749933. DOI: 10.1126/science.1749933.
- ↑ (en) Dunbrack, RL (2002). Rotamer Libraries in the 21st Century. Current Opinion in Structural Biology 12 (4): 431–440. PMID 12163064. DOI: 10.1016/s0959-440x(02)00344-5.
- ↑ Fraser JS, Clarkson MW, Degnan SC, Erion R, Kern D, Alber T (2009). Hidden alternative structures of proline isomerase essential for catalysis. Nature 462 (7273): 669–673. PMID 19956261. PMC 2805857. DOI: 10.1038/nature08615.
- ↑ (en) Davis IW, Arendall WB, Richardson DC, Richardson JS (2006). The backrub motion: how protein backbone shrugs when a sidechain dances. Structure 14 (2): 265–274. PMID 16472746. DOI: 10.1016/j.str.2005.10.007.
- ↑ Fraser JS, van den Bedem H, Samelson AJ, Lang PT, Holton JM, Echols N, Alber T (2011). Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America 108 (39): 16247–16252. PMID 21918110. PMC 3182744. DOI: 10.1073/pnas.1111325108.
- ↑ (en) Turton DA, Senn HM, Harwood T, Lapthorn AJ, Ellis EM, Wynne K (2014). Terahertz underdamped vibrational motion governs protein-ligand binding in solution. Nature Communications 5: 3999. PMID 24893252. DOI: 10.1038/ncomms4999.
- ↑ a b (en) Costa CH, Oliveira AR, Dos Santos AM, da Costa KS, Lima AH, Alves CN, Lameira J (2019). Computational study of conformational changes in human 3-hydroxy-3-methylglutaryl coenzyme reductase induced by substrate binding. Journal of Biomolecular Structure & Dynamics 37 (16): 4374–4383. PMID 30470158. DOI: 10.1080/07391102.2018.1549508.
- ↑ (en) Groban ES, Narayanan A, Jacobson MP (2006). Conformational changes in protein loops and helices induced by post-translational phosphorylation. PLOS Computational Biology 2 (4): e32. PMID 16628247. PMC 1440919. DOI: 10.1371/journal.pcbi.0020032.
- ↑ (en) Herzberg O, Chen CC, Kapadia G, McGuire M, Carroll LJ, Noh SJ, Dunaway-Mariano D (1996). Swiveling-domain mechanism for enzymatic phosphotransfer between remote reaction sites. Proceedings of the National Academy of Sciences of the United States of America 93 (7): 2652–7. PMID 8610096. PMC 39685. DOI: 10.1073/pnas.93.7.2652.
- ↑ (en) Gerstein M, Lesk AM, Chothia C (1994). Structural mechanisms for domain movements in proteins. Biochemistry 33 (22): 6739–49. PMID 8204609. DOI: 10.1021/bi00188a001.