Dimethylsulfiet
| Dimethylsulfiet | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
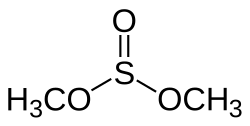
Structuurformule van dimehylsulfiet
| ||||
| ||||
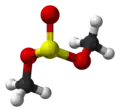
Ruimtelijk model van het molecuul
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Dimethylsulfiet | |||
| Andere namen | Zwaveligzuur, dimethyester DMSO3[1] | |||
| Molmassa | 110,13 g/mol | |||
| SMILES | O=S(OC)OC
| |||
| CAS-nummer | 616-42-2 | |||
| EG-nummer | 210-481-0 | |||
| Wikidata | Q418463 | |||
| Beschrijving | Heldere, kleurloze vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H226 - H315 - H319 - H335[2] | |||
| P-zinnen | P210 - P233 - P240 - P241 - P242 - P243 - P261 - P264 - Sjabloon:P264+P265 - P271 - P280 - P302+P352 - P303+P361+P353 - P304+P340 - P305+P351+P338 - Sjabloon:P319 - P321 - Sjabloon:P332+P317 - Sjabloon:P337+P317 - P362+P364 - P370+P378 - P403+P233 - P403+P235 - P405 - P501[2] | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,29 g/cm³ | |||
| Kookpunt | 126 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Dimethtylsulfiet is de ester van methanol en zwaveligzuur. Het heeft als formule , of met meer nadruk op de structuur: .
Synthese
Dimethylsulfiet wordt bereid in een molair 1:2 mengsel van thionylchloride en methanol.[3] De reactie kan gekatalyseerd worden door tertiaire amines. De reactie verloopt waarschijnlijk via methylchlorosulfinaat .[4] Deze stof heeft naast de methanol in het reactievat slechts een korte levensduur, en de ook bekende ontleding ervan naar chloormethaan en zwaveldioxide en treedt hooguit op een niet-waarneembaar niveau op.
Structuur en conformatie
Voor het molecuul van dimethylsulfiet zijn verschillend conformaties mogelijk. De GG-vorm (gauche-gauche) is de meest stabiele variant.[1] Elke C-O-binding staat gauche ten opzichte van de S=O-binding. In de figuur hieronder is een en ander grafisch weergegeven.
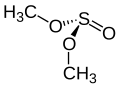
Structuurformule voor de GG conformatie van dimethylsulfiet.
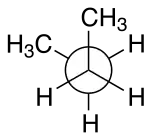
Gauche-conformatie voor butaan. De methyl-groepen zijn 60° ten opzichte van elkaar verdraaid.
Toepassingen
Dimethylsulfiet wordt in sommige polymeren toegepast als antioxidant.[5] Het is onderzocht als oplosmiddel voor de elektrolyten in hoge-energie batterijen.[6]
Zie ook
- Methylmethaansulfonaat, een
- Diethylsulfiet, een vergelijkbare sulfietester
- Dimethylsulfoxide
- Dimethylsulfaat, a sulfate ester
Externe links
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Dimethyl sulfite op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Referenties
- ↑ a b Borba, A.; Gómez-Zavaglia, A.; Simões, P. N. N. L.; Fausto, R. (2005). Matrix Isolation FTIR Spectroscopic and Theoretical Study of Dimethyl Sulfite. J. Phys. Chem. A 109 (16), pag.: 3578–3586. PMID: 16839024. DOI: 10.1021/jp050020t.
- ↑ a b c gegevens in PubChem van Dimethylsulfiet , gecontroleerd op: 25 febr. 2025
- ↑ Voss, Walter, Blanke, Erich (1931). .Über die Ester der schwefligen Säure (Esters of sulfurous acid). Justus Liebigs Annalen der Chemie 485: 258–83. DOI: 10.1002/jlac.19314850116.
- ↑ van Woerden, H. F. (December 1963). Organic Sulfites.. Chemical Reviews 63 (6): 557–571. DOI: 10.1021/cr60226a001.
- ↑ Guenther, A., Koenig, T., Habicher, W. D., Schwetlick, K. (1997). Antioxidant action of organic sulfites. I. Esters of sulfurous acid as secondary antioxidants. Polymer Degradation and Stability 55 (2), pag.: 209–216. DOI: 10.1016/S0141-3910(96)00150-4.
- ↑ N. P. Yao, E. D'Orsay, D. N. Bennion (1968). Behavior of Dimethyl Sulfite as a Potential Nonaqueous Battery Solvent. J. Electrochem. Soc. 115 (10): 999–1003. DOI: 10.1149/1.2410917.

