Dicarbonaat
| Dicarbonaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
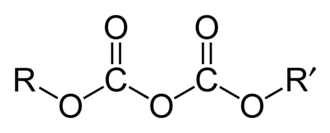
| ||||
Structuurformule van de dicarbonaat-eenheid
| ||||
| Algemeen | ||||
| Molecuulformule | (Basische vorm) | |||
| IUPAC-naam | Carboxylatocarbonaat | |||
| Andere namen | Pyrocarbonaat | |||
| Molmassa | 104,02 g/mol | |||
| SMILES | C(=O)([O-])OC(=O)[O-]
| |||
| CAS-nummer | 214335-04-3 | |||
| PubChem | 15238643 | |||
| Wikidata | Q5272324 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
-dicarbonate-from-xtal-2005-3D-balls.png)
In de organische chemie is een dicarbonaat, ook bekend onder de naam pyrocarbonaar een verbinding met de divalente structurele eenheid , die bestaat uit twee carbonaat-groepen die een zuurstofatoom delen. Deze verbindingen kunnen beschouwd worden als esters van het hypothetische dikoolzuur, , of . De twee belangrijkste voorbeelden van deze groep verbindingen zijn dimethyldicarbonaat en di-tert-bytyldicarbonaat.
Het is een van de koolstof-zuurstof-anionen, slechts bestaand uit koolstof en zuurstof. Dicarbonaatzouten zijn instabiel, maar het anion kan als intermediaire component aanwezig zijn in carbonaat-oplossingen.[2]
De naam bicarbonaat wordt heel soms, foutief, gebruikt om het bicarbonaat-ion (waterstofcarbonaat, ) aan te duiden of de organische groep .
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Dicarbonate op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Verwijzingen in de tekst
- ↑ Plácido García, Helge Willner, Maximiliano Burgos Paci (2005). Bis(trifluoromethyl)dicarbonate, CF3OC(O)OC(O)OCF3. J. Fluorine Chem. 126 (6): 984–990. DOI: 10.1016/j.jfluchem.2005.05.002.
- ↑ Zeller, Klaus-Peter, Schuler, Paul, Haiss, Peter (2005). The hidden equilibrium in aqueous sodium carbonate solutions: Evidence for the formation of the dicarbonate anion. Eur. J. Inorg. Chem. 2005 (1): 168–172. DOI: 10.1002/ejic.200400445.