Zilver(I,III)oxide
| Zilver(I,III)oxide | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
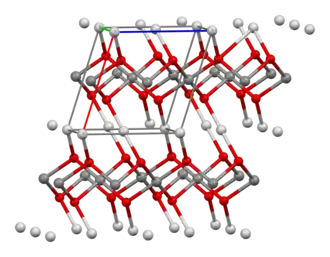
| |||||
■ Ag(I) ■ Ag(III) ■ O Zilver(I,III)oxide | |||||
| Algemeen | |||||
| Molecuulformule | |||||
| IUPAC-naam | Zilver(I,III)oxide | ||||
| Andere namen | Tetrazilvertetroxide, zilverperoxide, argenticoxide, zilversuboxide, Divasil, tetrazilvertetraoxide | ||||
| Molmassa | (AgO): 123,87 g/mol | ||||
| SMILES | [Ag]O[Ag].O=[Ag]O[Ag]=O
| ||||
| CAS-nummer | 1301-96-8 | ||||
| EG-nummer | 215-098-2 | ||||
| PubChem | 44150047 | ||||
| Wikidata | Q2380600 | ||||
| Beschrijving | grijs-zwart poeder | ||||
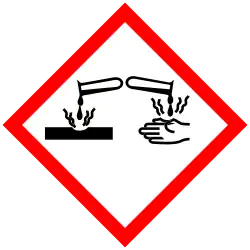
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H272 - H315 - H319 _ H335 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | 7,48 g/cm³ | ||||
| Smeltpunt | (ontleed) 100 °C | ||||
| Oplosbaarheid in water | 0.027 g/L | ||||
| Goed oplosbaar in | alkali | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Zilver(I,III)oxide of tetrazilvertetroxide is de anorganische verbinding met de formule . Tetrazilvertetroxide werd in het verleden ook zilverperoxide genoemd. Dit is niet terecht omdat de verbinding geen peroxide-ionen, bevat.
Synthese
De bereiding van het zout gebeurt door in basisch milieu bij 90 °C langzaam een oplossing van een zilver(I)-zout toe te voegen aan een oplossing van natriumpersulfaat waarbij de donkerbruine stof ontstaat.[1]
Reacties
In water ontleedt het zout onder vorming van zuurstofgas. In geconcentreerd salpeterzuur lost het op onder vorming van een bruine oplossing die Ag2+-ionen bevat.[3]
Toepassing
De stof vindt, vaak onder de naam zilver(II)oxide, toepassing in de zilver-zinkbatterij.
Structuur
Hoewel de empirische formule de indruk wekt dat tetrazilvertetroxide zilver met de oxidatiegetal 2+ bevat, is de structuur van de verbinding ongebruikelijk: het is een combinatie van twee zilveroxides met verschillende oxidatiegetallen.[4]
De kristallografische eenheidscel bevat vier zilver- en vier zuurstofionen. Elke eenheidscel bevat twee soorten zilverionen: twee zilverionen die met één zuurstofatoom gekoppeld zijn. Zilver heeft hier oxidatiegetal (1+). De andere twee zilverionen zijn met drie zuurstofatomen gekoppeld, en hebben oxidatiegetal (3+). De verbinding kan daarom beter beschreven worden als of als .[5]
Röntgendiffractie laat zien dat de zilverionen twee verschillende coördinatieomgevingen vertonen: één waarbij zilver lineair vooral met twee zuurstofatomen gekoppeld is en een waarbij de coördinatie uit vier coplanaire zuurstof-atomen bestaat.[1]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Silver(I,III) oxide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ N. Hammer, Jacob Kleinberg: Silver(II) oxide. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, ISBN 0-88275-165-4, S. 12 f
- ↑ Peter Fischer, Martin Jansen "Electrochemical Syntheses of Binary Silver Oxides" 1995, vol. 30, pp. 50–55. DOI:10.1002/9780470132616.ch11
- ↑ David Tudela "Silver(II) Oxide or Silver(I,III) Oxide?" J. Chem. Educ., 2008, volume 85, p 863. DOI: 10.1021/ed085p863
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8, p 1181