Waterstofjodide
| Waterstofjodide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van waterstofjodide
| ||||

| ||||
Molecuulmodel van waterstofjodide
| ||||
| Algemeen | ||||
| Molecuulformule | HI | |||
| IUPAC-naam | waterstofjodide | |||
| Andere namen | joodwaterstof | |||
| Molmassa | 127,91 g/mol | |||
| SMILES | I
| |||
| CAS-nummer | 10034-85-2 | |||
| EG-nummer | 233-109-9 | |||
| PubChem | 24841 | |||
| Wikidata | Q2462 | |||
| Beschrijving | Kleurloos gas met een prikkelende geur[1] | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
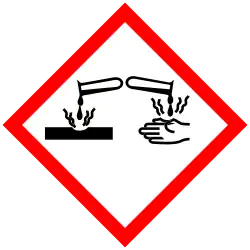
| H-zinnen | H314 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338 - P310 | |||
| EG-Index-nummer | 053-002-00-9 | |||
| VN-nummer | 2197 | |||
| ADR-klasse | Gevarenklasse 2.3 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Smeltpunt | −51[1] °C | |||
| Kookpunt | −35,4[1] °C | |||
| Oplosbaarheid in water | 425[1] g/L | |||
| Goed oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = −11 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Waterstofjodide is een kleurloos gas, dat zeer goed in water oplost, waarbij een gele oplossing gevormd wordt. Het is een zeer sterk anorganisch zuur (de pKa bedraagt immers −11).
Synthese
Industrieel wordt deze stof bereid door elektrolyse van de twee samenstellende enkelvoudige componenten in de gasfase, bij een temperatuur van 500 °C, in aanwezigheid van een platina-katalysator:
Soms wordt ook de reactie van jood en hydrazine gebruikt:
Door het borrelen van waterstofsulfide doorheen een geconcentreerde oplossing van di-jood wordt een oplossing van waterstofjodide gevormd:
Het gevormde waterstofjodide kan worden weggedestilleerd en het neergeslagen zwavel kan worden afgefiltreerd.
Daarnaast kan ook water en fosfortrijodide dit zuur vrijstellen:
Nog een alternatief is het verhitten van een mengsel van di-jood en colofonium.[2]
Eigenschappen en reacties
Bij verwarmen ontleedt waterstofjodide in de enkelvoudige stoffen diwaterstof en di-jood:
De hoge oplosbaarheid van waterstofjodide in water (425 liter gas lost op in 1 liter water), kan worden verklaard door de zuur-basereactie die optreedt tussen beide componenten:
Water, dat met een pKa van 16 een veel minder sterk zuur is dan waterstofjodide, wordt geprotoneerd tot het hydroxonium-ion.
Waterstofjodide wordt aan de lucht spontaan geoxideerd tot waterstoftrijodide, dat een karakteristieke donkerbruine kleur bezit:[3]
Net zoals met waterstofbromide en waterstofchloride ondergaan alkenen een additie met waterstofjodide, waardoor het overeenkomstig joodalkaan wordt gevormd:
Toepassingen
Waterstofjodide wordt in de industrie aangewend om kaliumjodide te bereiden:
Dit kaliumjodide wordt in kleine hoeveelheden toegevoegd aan keukenzout.
De ontleding van waterstofjodide wordt in de zwavel-jodiumcyclus gebruikt voor de productie van waterstofgas.