Tetracyano-etheen
| Tetracyano-etheen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
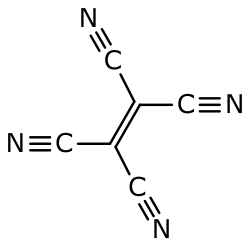
Structuurformule van tetracyano-etheen
| ||||
| ||||
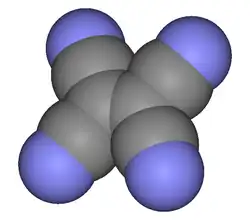
Ruimtelijk model van tetracyano-etheen
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Dicyanobuteendinitril | |||
| Andere namen | Etheentetracarbonitril, TCNE | |||
| SMILES | N#CC(C#N)=C(C#N)C#N
| |||
| CAS-nummer | 670-54-2 | |||
| PubChem | 12635 | |||
| Wikidata | Q413864 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H300 - H312 - H332[1] | |||
| P-zinnen | P261 - P264 - P280 - P301+P310 - P302+P352+P312 - P304+P340+P312 | |||
| EG-Index-nummer | 211-578-0[1] | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,35 g/cm³ | |||
| Smeltpunt | 199 °C | |||
| Sublimatiepunt | 130-140 °C (0,1 mmHg)[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetracyanoetheen (TCNE), meer systematisch: dicyanobuteendinitril, is een organische verbinding met de formule , of met meer nadruk op de structuur: . Het is een kleurloze, vaste stof, hoewel monsters van de stof meestal vuil wit zijn.
Synthese
TCNE wordt gesynthetiseerd via bromering van propaandinitril in aanweziheid van KBr. Hierbij ontstaat een kaliumbromidecomplex dat vervolgens onder invloed van koper gedehalogeneerd wordt.[2]
Reacties
Oxidatie
Oxidatie van TCNE met waterstofperoxide geeft het overeenkomstige epoxide.[3]
Base
In aanwezigheid van een base reageert TCNE met propaandinitril. Hierbij ontstaan zouten met het pentacyanopropenide-anion:[4]
De ontstane waterstof-ionen worden door de base opgenomen.
Redoxreacties
TCNE is een electronenacceptor. Cyanogroepen hebben lage π* orbitalen, en de aanwezigheid van vier van die groepen, geconjugeerd met de centrale dubbele binding, leidt tot een elektrofiel alkeen. TCNE heeft een redoxpotentiaal van - 0,27 Volt (t.o.v. ferroceen).[5]
Het gemak waarmee TCNE elektronen accepteert heeft geleid tot een groot aantal charge transfer complexen[6] en moleculeire stoffen met magnetische eigenschappen.
De lengte van de centrale koolstof-koolstof-binding in TCNE is 135 pm[7] Bij reductie (het opnemen van een elektron) wordt de binding langer, 141–145 pm, afhankelijk van het tegenion.[8]
Veiligfheid
In vochtige lucht hydrolyseert TCNE waarbij waterstofcyanide. De stof dient in overeenstemming daarmee behandeld te worden.[2]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Tetracyanoethylene op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b c Productinformatie van Merck: Tetracyanoethylene, geraadpleegd op: 19 maart 2025.
- ↑ a b c Carboni, R. A. (1959). Tetracyanoethylene. Org. Synth. 39, pag.: 64. DOI: 10.15227/orgsyn.039.0064.
- ↑ Linn, W. J. (1969). Tetracyanoethylene Oxide. Org. Synth. 49, pag.: 103. DOI: 10.15227/orgsyn.049.0103.
- ↑ Middleton, W. J.; Wiley, D. W. (1961). Tetramethylammonium 1,1,2,3,3-Pentacyanopropenide. Org. Synth. 41, pag.: 99. DOI: 10.15227/orgsyn.041.0099.
- ↑ Connelly, N. G., Geiger, W. E. (1996). Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews 96 (2): 877–910. PMID 11848774. DOI: 10.1021/cr940053x.
- ↑ Chittipeddi, Sailesh, Cromack, K. R., Miller, Joel S., Epstein, A. J. (22 juni 1987). Ferromagnetism in Molecular Decamethylferrocenium Tetracyanoethenide (DMeFc TCNE). Physical Review Letters 58 (25): 2695–2698. ISSN: 0031-9007. PMID 10034821. DOI: 10.1103/physrevlett.58.2695.
- ↑ Becker, P.; Coppens, P.; Ross, F. K. (1973). Valence electron distribution in cubic tetracyanoethylene by the combined use of x-ray and neutron diffraction. Journal of the American Chemical Society 95 (23), pag.: 7604–7609. DOI: 10.1021/ja00804a010.
- ↑ Bock, H.; Ruppert, K. (1992). Structures of charge-perturbed or sterically overcrowded molecules. 16. The cesium tetracyanoethylenide radical salt. Inorganic Chemistry 31 (24), pag.: 5094–5099. DOI: 10.1021/ic00050a032.
