Runderalbumine
| Runderalbumine | ||||
|---|---|---|---|---|
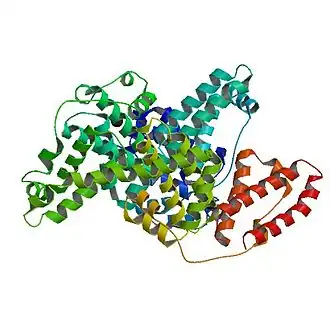
| ||||
Lintdiagram van runderalbumine
| ||||
| Eigenschappen | ||||
| Molecuulmassa | 66,5 kDa | |||
| Lengte | 583 aminozuren aminozuren | |||
| Identificatie | ||||
| Organisme | Bos taurus | |||
| Symbool | ALB | |||
| Externe identificaties | ||||
| UniProt | P02769 | |||
| CAS | 9048-46-8 | |||
| ||||
Runderalbumine (Engels: bovine serum albumin), vaak afgekort als BSA, is een groot eiwit (het albumine) dat geïsoleerd wordt runderbloed. Het is een veel gebruikt labreagens in moleculair onderzoek. BSA is een zeer stabiel, wateroplosbaar en niet-reactief eiwit. Om deze reden kent het een aantal algemene toepassingen wordt in de biochemie, met name als blokkeerstof of stabilisator.
In experimenteel biochemisch onderzoek wordt BSA algemeen gebruikt als blokkeerstof om niet-specifieke interacties (achtergrondsignaal) tegen te gaan, onder andere bij ELISA-tests, de Western blot en immunohistochemie. Het wordt ook gebruikt in eiwitkwantificaties om standaardreeksen te maken, bijvoorbeeld in de Bradford-assay. Ook wordt het gebruikt om de negatieve lading van erytrocyten weg te nemen bij een IAGT (indirecte antiglobulinetest). Ten slotte wordt het gebruikt om restrictie-enzymen te stabiliseren.
Eigenschappen

Runderalbumine in extracellulaire vorm bestaat uit 583 aminozuren. Het full-lengte polypeptide bevat een signaalsequentie van 18 aminozuren dat voor excretie in de bloedbaan wordt weggeknipt. Het eiwit is opgebouwd uit drie verschillende, redelijk homologe domeinen.[1]
Het iso-elektrisch punt van BSA in water (bij 25°C) is 4,7 en de optische absorbantie bedraagt 0,667 bij een golflengte van 280 nanometer.[2] De bijbehorende extinctie-coëfficient is 43.824 M−1cm−1.
- ↑ (en) Majorek KA, Porebski PJ, Dayal A, Zimmerman MD, Jablonska K, Stewart AJ, Chruszcz M, Minor W (2012). Structural and immunologic characterization of bovine, horse, and rabbit serum albumins. Molecular Immunology 52 (3–4): 174–182. PMID 22677715. PMC 3401331. DOI: 10.1016/j.molimm.2012.05.011.
- ↑ (en) Ge S, Kojio K, Takahara A, Kajiyama T (1998). Bovine serum albumin adsorption onto immobilized organotrichlorosilane surface: influence of the phase separation on protein adsorption patterns. Journal of Biomaterials Science. Polymer Edition 9 (2): 131–150. PMID 9493841. DOI: 10.1163/156856298x00479.