Glomuscel
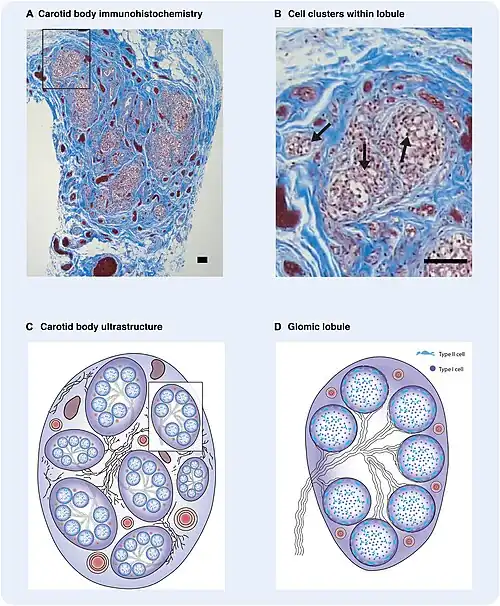

Glomuscellen bevinden zich voornamelijk in de glomera carotica (carotislichaampje) en glomera aortica (aorticalichaampje). Glomus type I-cellen zijn perifere chemoreceptoren die de zuurstof-, koolstofdioxide- en pH-waarden van het bloed detecteren. Wanneer de pH van het bloed daalt, de partiële zuurstofdruk (pO2) daalt of de partiële koolstofdioxidedruk (pCO2) stijgt, geven de carotislichaampjes en de aorticalichamaampjes een signaal aan de dorsale ademhalingsgroep in de medulla oblongata om het volume en de ademhalingsfrequentie te verhogen.[1] De glomuscellen hebben een hoge stofwisselingssnelheid en een goede bloedperfusie en zijn daarom gevoelig voor veranderingen in de arteriële bloedgasspanning. Glomus type II-cellen zijn epitheliale steuncellen met een vergelijkbare ondersteunende functie als gliacellen.[2][3][4]
Structuur
Glomuscellen zijn het meest voorkomende celtype in het carotislichaampje met een celaantal variërend van 12.000 glomus type I-cellen bij de rat tot 60.000 bij de kat. Elektronenmicroscopisch onderzoek heeft twee celklassen in het carotislichaampje van de rat geïdentificeerd: glomus type I-cellen en glomus type II-cellen. Glomuscellen hebben een ovale of polygonale vorm met een bolvormige of eivormige kern en een goed ontwikkeld golgicomplex. Er zijn twee soorten vesikels: heldere, gladde en gecoate vesikels, waarvan de laatste elektronendicht materiaal bevatten, wat wijst op de aanwezigheid van catecholamines. Glomus type II-cellen onderscheiden zich van glomus type !-cellen door de afwezigheid van zowel cytoplasmatische organellen als vesikels met een dichte kern. Glomus type I-cellen vormen een heterogene populatie bestaande uit cellen van subtype A en B. Glomuscellen van type A zijn bolvormig met een diameter van ongeveer 8–15 μm, terwijl glomuscellen van type B onregelmatiger van vorm lijken. Glomus type I-cellen (met name subtype B) bezitten cytoplasmatische uitlopers, waarvan sommige meer dan 40 μm lang zijn, die met de leeftijd in lengte toenemen. Wanneer glomus type I-cellen in vitro worden gekweekt, verdwijnen deze uitlopers aanvankelijk en worden de cellen bolvormiger. In celculturen die langer dan 48 uur worden bewaard, keren ze echter terug. Ondanks deze fenotypische verschillen kunnen glomus type I-cellen worden onderscheiden van type II-cellen en andere celtypen door hun affiniteit voor pinda-agglutinine (PNA), dat kan worden gelabeld met een fluorescerende marker.[5]
Functie
Glomus type I-cellen zijn chemoreceptoren die de partiële zuurstofdruk (pO2), de partiële koolstofdioxidedruk (pCO2) en de pH van het arteriële (slagaderlijke) bloed controleren. Glomus type I-cellen zijn secretoire sensorische zenuwcellen die neurotransmitters afgeven als reactie op hypoxemie (lage pO2), hypercapnie (hoge pCO2) of acidose (lage pH). Signalen worden doorgegeven aan de sensorische zenuwvezels van de carotis sinuszenuw.[6] Deze informatie wordt naar het ademhalingscentrum gestuurd en helpt de hersenen bij het reguleren van de ademhaling.
Een toename van intracellulair Ca2+ mobiliseert de intracellulaire neurotransmitterbevattende vesikels naar het celmembraan en vervolgens wordt de afgifte van de inhoud van de vesikels in de extracellulaire synaptische ruimte geactiveerd.[5]
De signalering binnen de chemoreceptoren wordt vermoedelijk gemedieerd door de afgifte van neurotransmitters door de glomus type 1-cellen, waaronder dopamine, noradrenaline, acetylcholine, substantie P, vasoactief intestinaal peptide en enkefalines.[7] Vasopressine blijkt de reactie van glomus type 1-cellen op hypoxie te remmen, vermoedelijk omdat de gebruikelijke reactie op hypoxie vasodilatatie is, wat in geval van hypovolemie moet worden vermeden.[8] Bovendien reageren glomuscellen zeer goed op angiotensine II via angiotensine II-receptorantagonist type 1, wat informatie verschaft over de vocht- en elektrolytenstatus van het lichaam.[9]
Innervatie
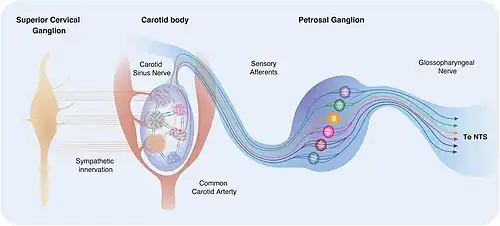
De glomus type I cellen van het carotislichaampje worden geïnnerveerd door de sensorische zenuwcellen die zich in het ganglion inferior van de nervus glossopharyngeus bevinden.[10] De carotis sinuszenuw is de tak van de nervus glossopharyngeus die ze innerveert. Als alternatief worden de glomus type I cellen van het aortalichaampje geïnnerveerd door sensorische zenuwcellen die zich in het ganglion inferior van de nervus vagus bevinden. Centraal vormen de axonen van de zenuwcellen die glomus type I cellen innerveren een synaps in het caudale deel van de solitaire nucleus in de medulla oblongata. Glomus type II cellen worden niet geïnnerveerd.
Ontwikkeling
Glomus type I-cellen zijn embryonaal afkomstig van de neurale lijst met een neuronale afstammingslijn afkomstig van het van het ganglion cervicale superius.[2] In het carotislichaampje hebben de ademhalings-chemoreceptoren postnataal (na de geboorte) een periode nodig om functionele volwassenheid te bereiken.[11] This maturation period is known as resetting.[12] Deze rijpingsperiode staat bekend als 'resetten'.[12] Bij de geboorte vertonen de chemoreceptoren een lage gevoeligheid voor zuurstofgebrek, maar dit neemt toe in de eerste paar dagen of weken van het leven. De mechanismen die ten grondslag liggen aan de postnatale volwassenheid van chemotransductie zijn onduidelijk.[6]
Klinische betekenis
Clusters van glomuscellen, waarvan de carotislichaampjes en de aortalichaampjes de belangrijkste zijn, worden parasympathische paraganglia genoemd. Ze zijn ook aanwezig langs de nervus vagus, in het binnenoor, in de longen en op andere plaatsen. Neoplasmata van glomuscellen staan bekend als paraganglioom en zijn over het algemeen niet-kwaadaardig.[13]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Globus cell op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Oxygen sensing : responses and adaptation to Hypoxia. Dekker, New York (2003), 200, 232. ISBN 978-0824709600.
- ↑ a b Pearse AG, Polak JM, Rost FW, Fontaine J, Le Lièvre C, Le Douarin N (1973). Demonstration of the neural crest origin of type I (APUD) cells in the avian carotid body, using a cytochemical marker system. Histochemie 34 (3): 191–203. PMID 4693636. DOI: 10.1007/bf00303435.
- ↑ Lawson, W (January 1980). The neuroendocrine nature of the glomus cells: an experimental, ultrastructural, and histochemical tissue culture study.. The Laryngoscope 90 (1): 120–44. PMID 6243386. DOI: 10.1288/00005537-198001000-00014.
- ↑ Eyzaguirre, C, Fidone, SJ (November 1980). Transduction mechanisms in carotid body: glomus cells, putative neurotransmitters, and nerve endings.. The American Journal of Physiology 239 (5): C135-52. PMID 6108075. DOI: 10.1152/ajpcell.1980.239.5.C135.
- ↑ a b Gold OMS, Bardsley EM, Ponnampalam AP, Pauza AG and Paton JFR (2022) Cellular basis of learning and memory in the carotid body. Front. Synaptic Neurosci. 14:902319. doi: 10.3389/fnsyn.2022.902319
- ↑ a b Carroll, JL, Kim, I (15 november 2005). Postnatal development of carotid body glomus cell O2 sensitivity.. Respiratory Physiology & Neurobiology 149 (1–3): 201–15. PMID 15886071. DOI: 10.1016/j.resp.2005.04.009.
- ↑ Pardal, R., Ludewig, U., Garcia-Hirschfeld, J. (11 February 2000). Secretory responses of intact glomus cells in thin slices of rat carotid body to hypoxia and tetraethylammonium. Proceedings of the National Academy of Sciences 97 (5): 2361–2366. PMID 10681419. PMC 15806. DOI: 10.1073/pnas.030522297.
- ↑ Wang, ZZ, He, L, Stensaas, LJ (February 1991). Localization and in vitro actions of atrial natriuretic peptide in the cat carotid body.. Journal of Applied Physiology 70 (2): 942–6. PMID 1827111. DOI: 10.1152/jappl.1991.70.2.942.
- ↑ Allen, A. M. (1 August 1998). Angiotensin AT1 receptor-mediated excitation of rat carotid body chemoreceptor afferent activity. The Journal of Physiology 510 (3): 773–781. PMID 9660892. PMC 2231066. DOI: 10.1111/j.1469-7793.1998.773bj.x.
- ↑ (en) Gonzalez, Constancio, Conde, Silvia V., Gallego-Martín, Teresa, Olea, Elena, Gonzalez-Obeso, Elvira (2014). Fernando de Castro and the discovery of the arterial chemoreceptors. Frontiers in Neuroanatomy 8. ISSN: 1662-5129. PMID 24860435. PMC 4026738. DOI: 10.3389/fnana.2014.00025.
- ↑ Hempleman, SC, Pilarski, JQ (31 August 2011). Prenatal development of respiratory chemoreceptors in endothermic vertebrates.. Respiratory Physiology & Neurobiology 178 (1): 156–62. PMID 21569865. PMC 3146631. DOI: 10.1016/j.resp.2011.04.027.
- ↑ a b Carroll, JL, Kim, I (1 January 2013). Carotid chemoreceptor "resetting" revisited.. Respiratory Physiology & Neurobiology 185 (1): 30–43. PMID 22982216. PMC 3587794. DOI: 10.1016/j.resp.2012.09.002.
- ↑ Anne Marie McNicol (2010). Endocrine Pathology: Differential Diagnosis and Molecular Advance, Springer, "Chapter 12: Adrenal medulla and paraganglia", p. 281.