Cyclopentadienylcomplex
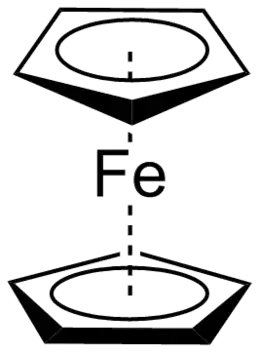

Een cyclopentadiënylcomplex is een coördinatieverbinding, meer bepaald een metalloceen, van een metaalion met één of meer cyclopentadiënylanionen, in brutoformules afgekort tot Cp. Daarnaast kunnen ook andere liganden aanwezig zijn, zoals chloride, koolstofmonoxide, 2,2'-bipyridine of trifenylfosfine. Op basis van het type binding met de cyclopentadiënyleenheid worden deze complexen in drie groepen verdeeld:
- π-complexen
- σ-complexen
- ionaire complexen
Er is al een groot aantal complexen gesynthetiseerd en veel ervan hebben interessante katalytische eigenschappen.[1]
Cyclopentadiënyl als ligand
Het cyclopentadiënyl-anion is het anion dat ontstaat na deprotonering van cyclopentadieen. Het is een eenwaardig negatief geladen ion dat met verschillende overgangsmetalen een complex vormt. Het eerste cyclopentadiënylcomplex dat is bereid was ferroceen, in 1951, waarvan de structuur drie jaar later werd opgehelderd.[2] Later volgden soortgelijke verbindingen zoals nikkeloceen, kobaltoceen en chromoceen. Bij deze verbinding zijn twee cyclopentadiënyl-anionen als ligand aanwezig en zij liggen evenwijdig aan elkaar, zodat deze verbindingen ook wel sandwichverbindingen worden genoemd.
Andere cyclopentadiënylcomplexen bezitten ook andere liganden, zoals de verbindingen titanoceendichloride en zirkonoceendichloride. Deze laatste wordt gebruikt als katalysator bij de polymerisatie van etheen tot polyetheen.
Types
De binding tussen het metaalion en het cyclopentadiënyl-anion geschiedt doorgaans door de orbitaaloverlap van de vijf geconjugeerde p-orbitalen op de vijf koolstofatomen met de d-orbitalen op het metaalion. De hapticiteit bedraagt dus 5, aangeduid als η5. Een uitzondering hierop vormt rhodoceen, waarbij dimerisatie optreedt en niet alle vijf koolstofatomen worden gebonden aan het metaal. Het cyclopentadiënyl-anion bindt in zeldzame gevallen via maar drie, dus η3, of maar een koolstofatoom, η1. Voorbeelden van dergelijke verbindingen zijn (η3-Cp)WCp(CO)2 en (η1-Cp)FeCp(CO)2.
Het aantal cyclopentadiënyl-liganden is doorgaans beperkt tot een, zoals in mangaancyclopentadiënyltricarbonyl, of twee bij een aantal metallocenen, maar in het geval van zeer grote metaalionen kunnen er ook meer liganden worden gebonden. Zo worden met thorium en uranium complexen gevormd met drie of vier cyclopentadiënyl-liganden.
π-cyclopentadiënylcomplexen
Metalen die met cyclopentadiënyl-liganden verbonden zijn door middel van pi-bindingen worden π-cyclopentadiënylcomplexen genoemd. Dit type binding is de meest voorkomende, voornamelijk bij de η5-complexen. Bij vrijwel alle overgangsmetalen wordt dit type binding waargenomen. Afhankelijk van de elektronenconfiguratie van het metaal komen er ook η3-complexen met pi-bindingen voor. Daarbij zijn drie koolstofatomen als een allyl-anionconfiguratie verbonden met het metaal, terwijl de overige twee koolstofatomen niet-bindend zijn en zich als een alkeen gedragen.
σ-cyclopentadiënylcomplexen
Bij σ-cyclopentadiënylcomplexen treedt een sigma-binding op tussen het metaal en één van de koolstofatomen van het cyclopentadiënyl-ligand. Dergelijke complexen worden gevormd met metalloïden en metalen uit de koolstofgroep, waaronder silicium, tin en lood. Trimethylcyclopentadiënylsilicium wordt vaak als precursor gebruikt voor de synthese van cyclopentadiënylcomplexen van metalen uit de titaangroep.
Ionaire cyclopentadiënylcomplexen
Ionaire cyclopentadiënylcomplexen betreffen complexen met ionen van alkali- en aardalkalimetalen. De binding in deze complexen zijn anders dan de naam doet vermoeden geen ionaire binding, maar eerder sterk polair en covalent. Ionaire cyclopentadiënylcomplexen worden doorgaans gesynthetiseerd door de directe reactie van cyclopentadieen met het alkali- of aardalkalimetaal in een niet-aromatisch oplosmiddel. Dergelijke verbindingen, waarvan cyclopentadiënylnatrium het belangrijkste voorbeeld is, worden bij de bereiding van π-cyclopentadiënylcomplexen gebruikt, zoals ferroceen.
- ↑ NS Kochetkova en YK Krynkina. Practical Applications of Cyclopentadienyl Complexes of Transition Metals, 1978. Russian Chemical Reviews 47, 5, blz 486
- ↑ RH Crabtree. The Organometallic Chemistry of the Transition Metals, 2014.