Chloornitramide
| Chloornitramide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
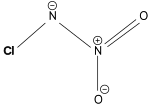
Structuurformule van het chloornitramide-ion
| ||||
| ||||
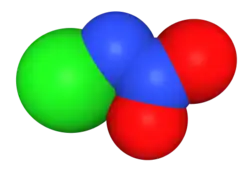
Ruimtelijk model van het chloornitramide-ion
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Chloro(nitro)azanide | |||
| Andere namen | Chloronitramide-anion | |||
| Molmassa | 95,46 g/mol | |||
| SMILES | [N-]([N+](=O)[O-])Cl
| |||
| PubChem | 149810380 | |||
| Wikidata | Q131302474 | |||
| ||||
Chloornitramide, , is een in het najaar van 2024 gekarakteriseerd bijproduct van de ontsmetting van drinkwater met behulp van anorganische chlooramines. De aanwezigheid van de stof was al langer bekend, maar een goede karakterisering, en daarmee naamgeving, ontbrak tot dan. De stof werd aangeduid met de afkorting "UP": Unidentified Product.[1][2][3][4][5]
Anorganische chlooramines worden vooral in de Verenigde Staten toegepast voor het ontsmetten van drinkwater. De aanwezigheid van chloornitramide, (onder de naam UP!) was bekend vanaf de vroege jaren 1980.[6] In november 2024 kwam aan het niet-geïdentificeerd zijn een eind met een wetenschappelijk onderzoek van Julian L. Fairey.[7] In Nederland wordt deze manier van waterontsmetting in verband met de schadelijkheid van gechloreerde bijproducten niet of nauwelijks toegepast.
Onderzoek
Vroeg onderzoek
Het anion werd voor het eerst waargenomen als een storende absorptie in het UV-gebied bij het controleren van de gehaltes chlooramine en dichlooramine in 1981.[6] Toen werd vastgesteld dat het werd gevormd tijdens de ontleding van beide chlooramines.[6] In 1990 werd aangetoond dat het naar alle waarschijnlijkheid een anion betrof.[8]
Isolatie
Ionchromatografie,een methode om ionen en ioniseerbare polariseerbare moleculen van elkaar te scheiden, werd gebruikt om chloornitramide te isoleren uit de oplossing van het mengsel van zouten waarin het gevormd was.[3]
Structuuropheldering
De structuur werd uiteindelijk in 2024 opgehelderd met behulp van ene combinatie van technieken. Eerst werd de moleculaire formule met behulp van massaspectrometrie vastgesteld: 1 chloor-, 2 stikstof- en 2 zuurstof-atomen: . Het ion was echter te klein om op basis van dit massaspectrum de structuur vast te stellen.[3][6] Wel kon een aantal mogelijke structuren opgesteld worden, waarna op basis van 15N-NMR en Infraroodspectroscopie werdvastgesteld.[6][9]
Vorming
Hoewel de vorming van chloornitramide uit chlooramine (of dichlooramine dat ontstaat in chlooramine-oplossingen) nog niet opgehelderd is (november 2024), nemen Fairey et al.[2] aan dat deze uitgangsstoffen met het nitroniumion, , zelf ook een vervalproduct van de chlooramines, reageert. De volgende serie reacties wordt verondersteld:[6][10]
| 1 | Dichlooramine hydrolyseert tot nitroxyl en waterstofchloride. | |
| 2 | Het gevormde nitroxyl reageert met opgeloste zuurstof tot peroxynitriet | |
| 3 | De vorming van nitronium is een van de bekende reacties van peroxynitriet. Het vrijkomende OH--ion reageert uiteraard snel met een van de in reactie 1 of 4 ook vrijkomende h+-ionen. | |
| 4 | Koppeling via het vrije elektronenpaar op stikstof in het chlooramine met de positieve lading in het nitronium-ion, gevolgd door het afstoten van de twee waterstofatomen, hetgeen eerst in een neutraal molecuul resulteert en vervolgens in het chloornitramide-anion. |
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Chloronitramide anion op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ niet-geïdentificeerd product
- ↑ a b Julian L. Fairey etal: Chloronitramide anion is a decomposition product of inorganic chloramines is het bronartikel, besproken in de zaterdagbijlage van Trouw, 23 november 2024
- ↑ a b c (en) Christensen, Jen, Solving a 40-year mystery, scientists ID chemical found in millions of Americans' tap water. CNN (21 november 2024). Geraadpleegd op 21 november 2024.
- ↑ "Mysterious chemical byproduct in U.S. tap water finally identified", 21 november 2024. Geraadpleegd op 22 november 2024.
- ↑ (en) Newly identified chemical in drinking water is likely in many homes and could be toxic, study finds. NBC News (21 november 2024). Geraadpleegd op 21 november 2024.
- ↑ a b c d e f (en) Fairey, Julian L., Laszakovits, Juliana R., Pham, Huong T., Do, Thien D., Hodges, Samuel D. (22 november 2024). Chloronitramide anion is a decomposition product of inorganic chloramines. Science 386 (6724): 882–887. ISSN: 0036-8075. PMID 39571006. DOI: 10.1126/science.adk6749.
- ↑ (en) Mystery chemical in drinking water identified. Chemical & Engineering News (21 november 2024). Geraadpleegd op 21 november 2024.
- ↑ (en) Leung, Solomon W., Valentine, Richard L. (June 1994). An unidentified chloramine decomposition product—I. Chemistry and characteristics. Water Research 28 (6): 1475–1483. DOI: 10.1016/0043-1354(94)90316-6.
- ↑ (en) McCurry, Daniel L. (22 november 2024). The chloramine dilemma. Science 386 (6724): 851–852. ISSN: 0036-8075. PMID 39571038. DOI: 10.1126/science.adt8921.
- ↑ (en) Wogan, Tim, First detected 40 years ago, a byproduct in chloraminated drinking water has finally been identified. Chemistry World. Geraadpleegd op 22 november 2024.