Boorsulfide
| Boorsulfide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Boorsulfide | |||
| Andere namen | Boorsesquisulfide, Diboortrisulfide | |||
| Molmassa | 117,80 g/mol | |||
| CAS-nummer | 12007-33-9 | |||
| PubChem | 123269 | |||
| Wikidata | Q2330068 | |||
| Beschrijving | Kleurloze kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| EG-Index-nummer | 234-504-9 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | Vast | |||
| Dichtheid | 1,55 g/cm³ | |||
| Smeltpunt | 563 °C | |||
| Kookpunt | ontleed °C | |||
| Oplosbaarheid in water | Ontleed g/L | |||
| Goed oplosbaar in | Ammonia | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | monoklien | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
-240,6 kJ/mol | |||
| S |
327 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
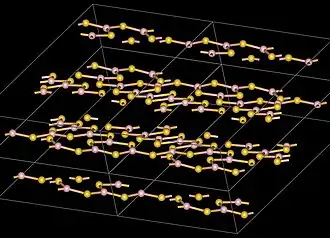
Boorsulfide is een chemische verbinding met de formule . Het is een vochtgevoelige vaste stof. De structuur van de stof is polymeer. Technisch is de stof interessant als basis voor speciale glassoorten en in de synthese van organische silfides.
Reacties
Net als de sulfides van silicium en fosfor reageert met sporen water, inclusief vocht in de lucht, waarbij waterstofsulfide ontstaat. De uiteindelijke reactie wordt door onderstaande (geïdealiseerde) reactievergelijking weergegeven:
. vormt makkelijk glazen met andere sulfiden zoals . Deze glassoorten zijn, in tegenstelling tot borosilicaatglas, doorzichtig voor de middengolflengtes van infrarood licht. Sommige van deze gemengde sulfides zijn in staat ionen snel te geleiden.[1]
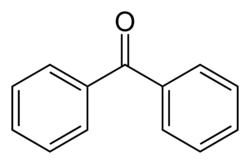
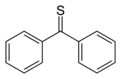
In de organische chemie wordt ingezet als reagens om ketonen om te zetten in de overeenkomstige thionen. Een voorbeeld daarvan is de synthese van thiobenzofenon uit benzofenon:
|
|
Theoretisch is een molverhouding benzofenon : boorsulfide gelijk aan 3 : 1, in de praktijk wordt een overmaat boorsulfide gebruikt.[2]
Synthese
De eerste synthese van deze stof in 1824 staat op naam van Jöns Jacob Berzelius. Hij liet amorf boor reageren met zwaveldamp.[3]
In 1858 werd de synthese door Friedrich Wöhler en Henri Etienne Sainte-Claire Deville gepubliceerd op basis van boor en waterstofsulfide.[4][5]
In 1908 werd een synthese van boorsulfide beschreven waarin het ijzer- of mangaanboride met waterstofsulfide reageerde bij 300 °C. Hoewel de omzetting complexer verloopt, kan de algemene reactie beschreven worden met de volgende vergelijking:[6]
Structuur
De boor-atomen in zijn trigonal vlak en georganiseerd in ringen van en met zwavelatomen als bruggen tussen de ringen. De gebrugde ringen vormen een gelaagde structuur met een afstand tussen de lagen van 355 pm. Hierin verschilt het sulfide van het booroxide, dat een driedimensionale structuur heeft.[7] De moleculaire, monomere vorm van heeft een V-vorm met een B-S-B-hoek van ongeveer 120°.[7]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Boron sulfide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Kincs, Joseph, Martin, Steve W. (1996). Non-Arrhenius Conductivity in Glass: Mobility and Conductivity Saturation Effects. Physical Review Letters 76 (1): 70–73. PMID 10060436. DOI: 10.1103/physrevlett.76.70.
- ↑ Sato, R. (2004). "Boron Trisulfide". In L. Paquette (ed.). Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. doi:10.1002/047084289X.rb255. ISBN 0471936235.
- ↑ Berzelius, J. (1824). Undersökning af flusspatssyran och dess märkvärdigaste föreningar. Kongliga Vetenskaps-Academiens Handlingar [Proceedings of the Royal Science Academy] 12: 46–98.
Reprinted in German as:
Berzelius, J. (1824). Untersuchungen über die Flußspathsäure und deren merkwürdigsten Verbindungen. Annalen der Physik und Chemie 78 (10): 113–150. DOI: 10.1002/andp.18240781002. see especially pages 145–147. - ↑ Wöhler, F., Deville, H. E. S.-C. (1858). Neue Beobachtungen über das Bor und einige seiner Verbindungen. Liebigs Annalen der Chemie und Pharmacie 105 (1): 67–73. DOI: 10.1002/jlac.18581050109.
- ↑ Wöhler, F., Deville, H. E. S.-C. (1858). Du Bore. Annales de Chimie et de Physique 52: 62–93.
- ↑ Hoffmann, J. (1908). Synthese von Borsulfid aus Ferro- und Manganbor. Zeitschrift für anorganische Chemie 59 (1): 127–135. DOI: 10.1002/zaac.19080590116.
- ↑ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.