Angeli's zout
| Angeli's zout | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
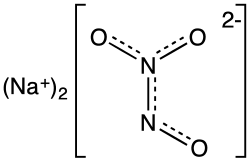
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | natriumtrioxodinitraat | |||
| SMILES | N(=O)[N+](=O)[O-].[Na+].[Na+]
| |||
| CAS-nummer | 13826-64-7 | |||
| PubChem | 10129945 | |||
| Wikidata | Q49001221 | |||
| Beschrijving | witte, vaste stof | |||
| ||||
Angeli's zout, vernoemd naar Angelo Angeli en systematisch natriumtrioxodinitraat genoemd, is een anorganische verbinding met de formule . Formeel is het oxidatiegetal van stikstof in deze verbinding 2+, een ongebruikelijke waarde voor dit element. Het is een kleurloos zout dat goed in water oplost. Bij chemisch onderzoek wordt dit zout gebruikt als bron voor het metastabiele nitroxyl . In de biologie treedt nitroxyl op als signaalmolecuul.[1] Als vaste stof komt het voor als: natriumtrioxodinitrate(II) monohydrate.
Synthese
Het zout is in 1896 voor het eerst beschreven door Angelo Angeli. Het wordt verkregen uit de reactie van hydroxylamine en een organisch nitraat. Dat laatste fungeert als bron voor nitronium, :[2][3]
- NH2OH + RONO2 + 2 NaOR′ → ROH + 2 R′OH + Na2N2O3
Structuur
Met behulp van röntgendiffractie is de kristalstructuur van het monohydraat bepaald. Het anion is vlak. Beginnend aan de ONN-zijde van het molecuul zijn de afstanden tussen de atomen 135 (O-N), 126 (N-N), 131 (N-O) en 132 pm. De hoeken tussen de bindingen zijn 112,9° (enkele O-N-N), 118,4° (N-N-OE) en 122,5° (N-N-OZ). Dit betekent dat de N-N-binding een dubbele band is en dat het Z-zuurstof-atoom iets wordt afgestoten door het "losse" zurstof-atoom op de andere stikstof. De negatieve lading wordt vooral door de zuurstof-atomen gedragen.[4]
Reacties
De reactie van Angeli's zout met secondaire amines wordt, in aanwezigheid van een protondonor, vrije stikstof gevormd, . Mogelijk verloopt dae reactie via een Intermediair isodiazeen. R[5]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Angeli's salt op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ (en) Nakagawa, H. (2013). Controlled release of HNO from chemical donors for biological applications. J. Inorg. Biochem. 118: 187–190. PMID 23140899. DOI: 10.1016/j.jinorgbio.2012.10.004.
- ↑ (it) Angeli, A. (1896). Sopra la nitroidrossilammina. Gazz. Chim. Ital. 26: 17–28.
- ↑ (en) Hughes, Martin N., Cammack, Richard (1999). Nitric Oxide, Part C: Biological and Antioxidant Activities. DOI:10.1016/S0076-6879(99)01092-7, "Synthesis, chemistry, and Applications of Nitroxyl Ion Releasers Sodium Trioxodinitrate or Angeli's Salt and Piloty's Acid", 279–287. ISBN 9780121822026.
- ↑ (en) Hope, Hakon, Sequeira, Michael R. (February 1973). Angeli's salt. Crystal structure of sodium trioxodinitrate(II) monohydrate, Na2N2O3·H2O. Inorganic Chemistry 12 (2): 286–288. DOI: 10.1021/ic50120a008.
- ↑ (en) Carey, Francis A., Sundberg, Richard J. (2007). Advanced Organic Chemistry. Part B: Reactions and Synthesis, 5th. Springer, New York, NY. ISBN 9781601195494.